Hullám-részecske kettősség- bármely mikrorészecske azon tulajdonsága, hogy észleli a részecske (testtest) és a hullám jeleit. A korpuszkuláris-hullám dualizmus legvilágosabban az elemi részecskékben nyilvánul meg. Az elektron, neutron, foton bizonyos körülmények között úgy viselkedik, mint a térben jól lokalizált anyagi objektumok (részecskék), amelyek bizonyos energiákkal és momentumokkal mozognak a klasszikus pályákon, más körülmények között pedig hullámként viselkednek, ami interferenciás és diffrakciós képességükben nyilvánul meg. . Tehát egy elektromágneses hullám, amely a szabad elektronokon szóródik, úgy viselkedik, mint az egyes részecskék - fotonok - áramlata, amelyek az elektromágneses mező kvantumai (a Compton-effektus), és a foton impulzusát a p \u003d h / λ képlet adja meg. , ahol λ az elektromágneses hullámhossz, h pedig Planck-állandó. Ez a képlet maga a dualizmus bizonyítéka. Ebben a bal oldalon egy egyedi részecske (foton) impulzusa, jobb oldalon pedig a foton hullámhossza látható. Az elektronok dualizmusa, amelyet részecskéknek szoktunk tekinteni, abban nyilvánul meg, hogy az egykristály felületéről visszaverve diffrakciós mintázat figyelhető meg, ami az elektronok hullámtulajdonságának megnyilvánulása. Az elektron korpuszkuláris és hullámkarakterisztikája közötti kvantitatív kapcsolat ugyanaz, mint a foton esetében: p = h/λ (p az elektron impulzusa, λ a de Broglie hullámhossza). Hullám-részecske kettősség áll a háttérben kvantumfizika.
A hullám (bunda) olyan folyamat, amely mindig olyan anyagi közeghez kapcsolódik, amely bizonyos térfogatot foglal el a térben.
64. Waves de Broglie. Elektrondiffrakció Mikrorészecskék hullámtulajdonságai.
A mikrorészecskék mozgásának hullámjellegének hipotézisében kapott elképzelések kialakulása az anyag korpuszkuláris-hullámos tulajdonságairól. Louis de Broglie a természetben az anyag- és fényrészecskék szimmetriájának gondolata alapján bármely mikrorészecskének valamilyen belső periodikus folyamatot tulajdonított (1924). Az E = hν és E = mc 2 képleteket kombinálva olyan összefüggést kapott, amely azt mutatja, hogy bármely részecskének megvan a sajátja. hullámhossz : λ B \u003d h / mv \u003d h / p, ahol p a hullámrészecske impulzusa. Például egy 10 eV energiájú elektronnál a de Broglie hullámhossz 0,388 nm. Később kiderült, hogy a mikrorészecske állapota a kvantummechanikában egy bizonyos komplexszel leírható hullámfüggvény koordináták Ψ(q), és a függvény modulusának négyzete |Ψ| A 2. ábra a koordinátaértékek valószínűségi eloszlását határozza meg. Ezt a függvényt először Schrodinger vezette be a kvantummechanikába 1926-ban. Így a de Broglie-hullám nem hordoz energiát, hanem csak valamilyen valószínűségi periodikus folyamat „fáziseloszlását” tükrözi a térben. Ezért a mikrovilág tárgyainak állapotának leírása az valószínűségi karakter, ellentétben a makrokozmosz tárgyaival, amelyeket a klasszikus mechanika törvényei írnak le.
A német fizikus, Elsasser a mikrorészecskék hullámtermészetére vonatkozó de Broglie elképzelésének bizonyítására kristályok használatát javasolta az elektrondiffrakció megfigyelésére (1925). Az USA-ban K. Davisson és L. Germer felfedezte a diffrakció jelenségét, amikor egy elektronsugár áthalad egy nikkelkristály lemezen (1927). Tőlük függetlenül az elektronok diffrakcióját fémfólián való áthaladáskor J.P. Thomson fedezte fel Angliában és P.S. Tartakovszkij a Szovjetunióban. Tehát de Broglie gondolata az anyag hullámtulajdonságairól kísérleti megerősítést nyert. Ezt követően diffrakciós, tehát hullámtulajdonságokat fedeztek fel az atom- és molekuláris nyalábokban. A korpuszkuláris hullám tulajdonságokkal nemcsak a fotonok és elektronok, hanem minden mikrorészecske is rendelkezik.
A mikrorészecskék hullámtulajdonságainak felfedezése azt mutatta, hogy a klasszikus fizika szempontjából minőségileg eltérőnek tekintett anyagformák, mint a mező (folyamatos) és az anyag (diszkrét), bizonyos feltételek mellett mindkettőben rejlő tulajdonságokat mutathatnak. formák. Ez az anyag ezen formáinak egységéről beszél. Tulajdonságaik teljes leírása csak ellentétes, de egymást kiegészítő elképzelések alapján lehetséges.
AZ ATOM KLASSZIKUS MODELLEI ÉS HIBAJAI.
Ötletek miről Az atomok nem oszthatatlan részecskék, és alkotóelemként tartalmaznak
részecskék elemi töltései, először a végén fogalmazták meg19. század Az "elektron" kifejezést George angol fizikus javasolta 1881-benStoney. 1897-ben az elektronhipotézis kísérleti kísérletet kapottmegerősítette Emil Wiechert és Joseph Jan Thomson tanulmányaiban. Ettől a pillanattól kezdve elkezdődött a különféle elektronikus modellek létrehozása.atomok és molekulák.Thomson első modellje azt feltételezte, hogy a pozitív töltés egyenletesszétszórva az atomban, és bele, mint a mazsola a zsemlébe,beágyazott elektronok.Világossá vált ennek a modellnek a kísérleti adatokkal való inkonzisztenciájaErnest Rutherford 1906-os kísérlete után, aki azt vizsgálta
az a-részecskék atomok általi szórásának folyamata. Tapasztalatból készültél,hogy a pozitív töltés a képződmény belsejében összpontosuljon, elengedhetetlenkisebb, mint egy atom mérete. Ezt a képződményt atomnak neveztékmag, melynek méretei 1 o-12 cm, az atom méretei pedig 1 o-in cm.
Az elektromágnesesség klasszikus fogalmaival összhangbanaz egyes elektronok és az atommag között Coulomb-erőnek kell hatniavonzerő. Ennek az erőnek a távolságtól való függése legyenugyanaz, mint a törvényben gravitáció. Ezért a mozgalom
Az atomban lévő elektronoknak olyannak kell lenniükhanem a bolygók mozgása Naprendszer. Így született meg a bolygómodellRutherford atom.A fenntarthatóság további feltárásaAz atom lenyűgöző eredményt adott:a számítások azt mutatták, hogy közben1 o-9 s az elektronnak az atommagra kell esnie
a sugárzás általi energiaveszteség miatt. Sőt, ez a modell adottaz atomok folytonos, nem pedig diszkrét emissziós spektruma.
BÓRATOM ELMÉLET.
Következő fontos lépés ban ben Az atomelmélet kidolgozását Niels Bohr végezte.
A legfontosabb hipotézis, amelyet Bohr terjesztett elő 1913-ban megjelent a diszkrét struktúra hipotézise
az elektron energiaszintje az atomban. Ez a pozíció energiával illusztrálva
diagramok. Hagyományosan energia ábrákon az energia a függőleges mentén rakódik le
tengelyek. A test gravitációs térben való mozgásának különbségeaz elektron mozgásából az atombana Bohr-hipotézis szerint azhogy a test energiája folyamatosan változhat,az elektronenergiát pedig negatív értékekenszámos diszkrét értéket vehet fel,ábrán kék szegmensekként láthatókszínek. Ezeket a diszkrét értékeket nevezték elenergiaszinteket, vagy egyébként energiát szinteket. Természetesen a diszkrét energiaszintek ötletePlanck hipotéziséből származott. Energia változáselektron Bohr elméletének megfelelően tudottcsak ugrásban fordulnak elő (egy energiaszintről egy másik). Bohr elmélete tökéletesen megmagyarázta a vonal karakterét
atomspektrumok. A diszkrétség okáról szóló kérdésre azonban
szintre, az elmélet valójában nem adott választ.
AZ ANYAG HULLÁMAI.
A mikrovilág elméletének kidolgozásának következő lépése az volt Louis de Broglie készítette. 1924-ben azt javasoltaa mikrorészecskék mozgását nem klasszikus mechanikaiként kell leírni
mozgás, hanem valamiféle hullámmozgás. Ez a törvényekből származik hullámmozgásra recepteket kell beszerezni a különbségek kiszámításáhozegyéb megfigyelhető mennyiségek. Tehát a tudományban, az elektromágneses hullámokkal együttmezők anyaghullámok jelentek meg.A részecskék mozgásának hullámtermészetére vonatkozó hipotézis merész volt, mintvalamint Planck sejtése a mező diszkrét tulajdonságairól. Kísérlet,közvetlenül megerősítve a hipotézistBroglie, csak 1927-ben adták át.Ebben a kísérletben azt figyelték megelektrondiffrakció kristályon,mint az elektromágneses diffrakció hullámok. Az anyag hullámaira vonatkozó hipotézis megengedettmagyarázza a diszkrét természetet
energiaszintek. Az elméletből hullámok, ismert volt, hogy a térben korlátozott hullám mindig isdiszkrét frekvenciák. Példa erre egy hullám egy ilyen musicalbenhangszer, mint egy furulya. A hangfrekvencia ebben az esetben meghatározásra kerüla tér méretei, amelyek a hullámot korlátozzák (a fuvola méretei).Kiderült, hogy ez a hullámok általános tulajdonsága.De Planck hipotézisével összhangban az elektromágneses kvantumfrekvenciaa hullámok arányosak a kvantum energiájával. Ezért az elektron energiájadiszkrét értékeket kell venni.De Broglie ötlete nagyon gyümölcsözőnek bizonyult, bár, mint már említettük,közvetlen kísérlet, amely megerősíti az elektron hullámtulajdonságait1926-ban Erwin Schrödinger levezette az egyenletet,amelynek az elektronhullámnak engedelmeskednie kell, és miután ezt megoldottaegyenletet alkalmazva a hidrogénatomra, megkapta az összes olyan eredményt, amelyképes volt megadni Bohr elméletét. Valójában ez volt a kezdetmodern elmélet folyamatok leírása a mikrokozmoszban, merta hullámegyenlet könnyen általánosítható volt különféle rendszerekre – sokelektronosatomok, molekulák, kristályok.Az elmélet fejlődése annak megértéséhez vezetett, hogy a hullámnak megfelelőrészecske, meghatározza a részecske megtalálásának valószínűségét egy adott pontbantér. Így a valószínűség fogalma bekerült a mikrovilág fizikájába.Alapján új elmélet a részecskének megfelelő hullám teljesen meghatározzarészecskék mozgása. De a hullámok általános tulajdonságai olyanok, hogy a hullámnem lokalizálható a tér egyetlen pontján sem, pl. értelmetlenbeszélni a részecske koordinátáiról egy adott időpontban.Ennek következménye az volt, hogy a mikrovilág fizikájából teljesen kizárták az ilyeneketolyan fogalmak, mint a részecske pályája és az elektronok pályájaatom. Az atom gyönyörű és vizuális bolygómodellje, mint kiderült,
Bohr elméletének hiányosságai az alapok felülvizsgálatának szükségességét jelezték kvantum elmélet valamint a mikrorészecskék (elektronok, protonok stb.) természetére vonatkozó elképzelések. Felmerült a kérdés, hogy mennyire átfogó egy elektron reprezentációja kis mechanikai részecske formájában, amelyet bizonyos koordinátákkal és bizonyos sebességgel jellemeznek.
Azt már tudjuk, hogy az optikai jelenségekben egyfajta dualizmus figyelhető meg. A diffrakció, interferencia (hullámjelenségek) mellett olyan jelenségek is megfigyelhetők, amelyek a fény korpuszkuláris természetét jellemzik (fotoelektromos hatás, Compton-effektus).
1924-ben Louis de Broglie azt feltételezte A dualizmus nem csak jellemző optikai jelenségek ,hanem univerzális. Az anyagrészecskék hullámtulajdonságokkal is rendelkeznek .
„Az optikában – írta Louis de Broglie – egy évszázadon át a korpuszkuláris mérlegelési módszert túlságosan elhanyagolták a hullámhoz képest; Fordított hiba történt az anyagelméletben? Feltéve, hogy az anyagrészecskék a korpuszkuláris tulajdonságokkal együtt hullámtulajdonságokkal is rendelkeznek, de Broglie az anyagrészecskék esetére ugyanazokat a szabályokat vitte át az egyik képről a másikra való átmenetre, amelyek a fényre is érvényesek.
Ha egy fotonnak van energiája és impulzusa, akkor egy bizonyos sebességgel mozgó részecske (például elektron) hullámtulajdonságokkal rendelkezik, pl. a részecskék mozgását hullámmozgásnak tekinthetjük.
A kvantummechanika szerint a tömeggel rendelkező részecske szabad mozgása més az impulzus (ahol υ a részecskesebesség) sík monokromatikus hullámként ábrázolható ( de Broglie hullám) hullámhosszal
| (3.1.1) |
ugyanabban az irányban terjednek (például a tengely irányában x), amelyben a részecske mozog (3.1. ábra).

A hullámfüggvény függése a koordinátától x képlet adja meg
| , | (3.1.2) |
ahol - hullámszám ,de hullám vektor a hullámterjedés irányába vagy a részecske mozgása mentén irányítva:
| . | (3.1.3) |
Ily módon monokromatikus hullám hullámvektora szabadon mozgó mikrorészecskéhez kapcsolódik, lendületével arányos vagy hullámhosszával fordítottan arányos.
Mivel egy viszonylag lassan mozgó részecske mozgási energiája, ezért a hullámhosszt energiával is kifejezhetjük:
| . | (3.1.4) |
Amikor egy részecske kölcsönhatásba lép valamilyen tárggyal - kristállyal, molekulával stb. – megváltozik az energiája: ennek a kölcsönhatásnak a potenciális energiája hozzáadódik hozzá, ami a részecske mozgásának megváltozásához vezet. Ennek megfelelően a részecskével összefüggő hullám terjedésének jellege megváltozik, és ez a minden hullámjelenségre jellemző elvek szerint történik. Ezért a részecskék diffrakciójának alapvető geometriai törvényszerűségei semmiben sem különböznek egyetlen hullám diffrakciójának szabályosságaitól sem. Bármilyen természetű hullám diffrakciójának általános feltétele a beeső hullámhossz összemérhetősége λ távolsággal d szórási központok között: .
Louis de Broglie hipotézise forradalmi volt, még abban a forradalmi időben is a tudományban. Ezt azonban hamarosan számos kísérlet is megerősítette.
A kvantummechanika egy modern elmélet, amely meghatározza a mikrorészecskék (elemi részecskék, atomok, molekulák, magok) és rendszereik leírásának módját és mozgástörvényeit. A kvantummechanikai fogalmak szokatlansága a klasszikus fizikához képest az alapvető fizikai modellek megtörésének időszakát nyitotta meg, ami nyilvánvalónak és elpusztíthatatlannak tűnt. Ez elsősorban a részecske fogalmára és mozgásának elveire vonatkozott.
Ez a fejezet nem csak a kvantummechanikáról ad fogalmat, hanem azokról az elképzelésekről és kísérletekről is, amelyek ehhez az elmélethez vezettek. Az elektronmikroszkópiát az elektronok hullámtulajdonságain alapuló módszernek tekintik.
28.1. DE BROYLE HIPOTÉZISE. KÍSÉRLETEK AZ ELEKTRONOK ÉS MÁS RÉSZecskék DIFRAKCIÓJÁRA
A kvantummechanika létrehozásának fontos lépése volt a mikrorészecskék hullámtulajdonságainak felfedezése. A hullámtulajdonságok gondolatát eredetileg Louis de Broglie francia fizikus (1924) terjesztette fel hipotézisként 1 .
A fizikában évekig az az elmélet dominált, amely szerint a fény elektromágneses hullám. Planck (hősugárzás), Einstein (fotoelektromos hatás) és mások munkája után azonban nyilvánvalóvá vált, hogy a fénynek korpuszkuláris tulajdonságai vannak.
1 De Broglie hipotézisét a részecskék hullámtulajdonságait megerősítő kísérletek előtt fogalmazták meg. De Broglie erről később, 1936-ban így írt: „... nem feltételezhetjük, hogy az elektron ugyanolyan kettős, mint a fény? Első pillantásra ez az ötlet nagyon merésznek tűnt. Hiszen mindig is elektromos töltésűnek képzeltük el az elektront anyagi pont, amely a klasszikus dinamika törvényeinek engedelmeskedik. Az elektron soha nem mutatott ki kifejezetten olyan hullámtulajdonságokat, mint például a fény az interferencia és a diffrakció jelenségeiben. Tudománytalan fantáziának tűnhet az a kísérlet, hogy egy elektronnak hullámtulajdonságot tulajdonítanak, ha erre nincs kísérleti bizonyíték.
ch. 24 megfigyelték, hogy a kristályos testeken röntgendiffrakció figyelhető meg; ezért az elektrondiffrakcióhoz kristályos anyagokat is kell használni.
K. Davisson és L. Germer volt az első, aki elektrondiffrakciót figyelt meg egyetlen nikkelkristályon, J.P. Thomson és tőle függetlenül P.S. Tartakovsky - fémfólián (polikristályos test).

ábrán A 28.1. ábra egy elektrongrammot mutat - egy diffrakciós mintát, amelyet az elektronok és egy polikristályos fólia kölcsönhatásából nyernek.
Összehasonlítva ezt az ábrát az ábrával. A 24.21. ábrán megfigyelhető az elektron- és röntgendiffrakció hasonlósága.
Más részecskék is képesek diffrakcióra, mind töltöttek (protonok, ionok stb.), mind semlegesek (neutronok, atomok, molekulák).
A röntgendiffrakciós analízishez hasonlóan a részecskediffrakció segítségével meghatározható az anyag atomjai és molekulái rendezett vagy rendezetlen elrendezése, valamint a kristályrácsok paramétereinek becslése.
Jelenleg az elektrondiffrakciós (elektrondiffrakciós) és a neutrondiffrakciós (neutrondiffrakciós) módszereket széles körben alkalmazzák.
Kérdések merülhetnek fel: mi történik az egyes részecskékkel, hogyan alakulnak ki a maximumok és minimumok az egyes részecskék diffrakciója során?
Kísérletek nagyon alacsony intenzitású elektronsugarak diffrakciójára, azaz. mintha különálló részecskék lennének, megmutatta, hogy ebben az esetben az elektron nem "kenődik" különböző irányokba, hanem egész részecskeként viselkedik. A diffrakciós objektummal való kölcsönhatás eredményeként eltérő irányú elektronelhajlás valószínűsége azonban eltérő. Az elektronok leginkább azokat a helyeket érik el, amelyek a számítás szerint megfelelnek a diffrakciós maximumoknak, a minimumokra való eltalálásuk kevésbé valószínű. Így a hullámtulajdonságok nemcsak az elektronok kollektívájára jellemzőek, hanem minden egyes elektronra külön-külön is.
28.2. ELEKTRON MIKROSZKÓP. AZ ELEKTRONIKAI OPTIKA FOGALMA
A részecskék hullámtulajdonságai nemcsak diffrakciós szerkezeti elemzésre használhatók, hanem egy tárgyról felnagyított képek készítésére is.
A (26.19)-ből az következik, hogy az optikai mikroszkóp felbontási határát elsősorban az emberi szem által érzékelt fény hullámhosszának határértéke határozza meg. Ebben a képletben a de Broglie hullámhossz értékét (28.3) behelyettesítve megtaláljuk az elektronmikroszkóp felbontási határát, amelyben a tárgy képét elektronnyalábok alkotják:
Könnyen belátható, hogy a felbontás határa z Az elektronmikroszkóp a gyorsító feszültségtől függ, és elérhető, hogy az sokkal kisebb, és a felbontása sokkal nagyobb, mint az optikai mikroszkópé.
Az elektronmikroszkóp és egyes elemei rendeltetésükben hasonlóak az optikaihoz, ezért a felépítését és működési elvét egy analógiával magyarázzuk meg. ábrán látható mindkét mikroszkóp diagramja. 28,2 (a - optikai; b - elektronikus).
Az optikai mikroszkópban a témával kapcsolatos információ hordozója AB egy foton, fény. A fényforrás általában egy izzólámpa /. A tárggyal való interakció (abszorpció, szórás, diffrakció) után a fotonfluxus átalakul, és információkat tartalmaz az objektumról. A fotonfluxus kialakítása optikai eszközök, elsősorban lencsék segítségével történik: 3. kondenzátor, 4. objektív, 5. okulár. Az A 1 B 1 képet a 7. szem (vagy fényképezőlap, fotolumineszcens képernyő stb.) rögzíti.
Az elektronmikroszkópban az objektumról információhordozó egy elektron, az elektronok forrása pedig egy fűtött katód 1. Az elektronok gyorsítását és a nyalábképzést egy fókuszáló elektróda és egy anód - rendszer - végzi. elektronágyúnak nevezik 2. A tárggyal való kölcsönhatás (főleg szóródás) után az elektronáramlás átalakul, és információkat tartalmaz az alanyról. Az elektronáramlás kialakulása hatása alatt történik elektromos mező(elektródák és kondenzátorok rendszere) és mágneses (rendszer-

ma tekercsek árammal). Ezeket a rendszereket a fényáramot képező optikai lencsék analógiájával elektronikus lencséknek nevezzük. (3 - kondenzátor; 4 - elektronikus, lencseként szolgál, 5 - kivetítés). A képet egy elektronérzékeny fényképezőlapra vagy katódlumineszcens képernyőre rögzítik 6.
Az elektronmikroszkóp felbontási határának becsléséhez helyettesítsünk be a (28.4) képletbe egy 100 kV-os gyorsítófeszültséget és egy 10 -2 rad nagyságrendű szögapertúrát (az elektronmikroszkópban körülbelül ilyen szögeket használnak). Akkor kapunk z ~ 0,1 nm, ami több százszor jobb, mint az optikai mikroszkópoké. A 100 kV-nál nagyobb gyorsítófeszültség alkalmazása, bár növeli a felbontást, bizonyos nehézségekkel jár, különösen előfordul
a vizsgált tárgy megsemmisítése nagy sebességű elektronok által. A gyakorlatban a legjobb elektronmikroszkóppal is 10 -10 m nagyságrendű felbontási határ érhető el; ez több százszor jobb, mint az optikai mikroszkópok.
Az elektronmikroszkóp előnyei közé tartozik a nagy felbontás, amely lehetővé teszi a nagy molekulák figyelembevételét, a gyorsítófeszültség és ebből adódóan a felbontási határ változtatásának lehetősége, valamint az elektronáramlás viszonylag kényelmes vezérlése mágneses és elektromos mezők segítségével. .
Mutassuk meg az elektronmikroszkóp működésének néhány jellemzőjét. Azokon a részein, ahol az elektronok repülnek, vákuumnak kell lennie, mert különben az elektronok levegő (gáz) molekulákkal való ütközése torzítja a képet. Ez az elektronmikroszkópos vizsgálati követelmény megnehezíti a vizsgálati eljárást, körülményesebbé és drágábbá teszi a berendezést. A vákuum eltorzítja a biológiai objektumok natív tulajdonságait, esetenként tönkreteszi vagy deformálja azokat.
Elektronmikroszkóppal csak nagyon vékony metszetek alkalmasak, mivel az elektronokat erősen elnyeli és szétszórja az anyag. Ezért bizonyos esetekben célszerű a tárgy vizsgált felületéről egy vékony műanyagrétegre lenyomatot készíteni. Ezt az eljárást replikációnak nevezik, és a felület műanyag másolatának nevezik másolat.

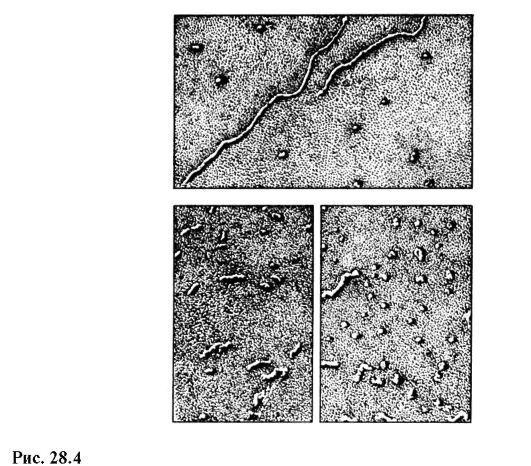
A modern hazai elektronmikroszkóp EVM-100 LM (28.3. ábra) maximálisan 600 000-szeres nagyítást ad, és garantált felbontási határt 3? 10 -10 m. ábrán. A 28.4. ábrán különböző állapotú RNS-molekulák képei láthatók, melyeket elektronmikroszkóppal készítettek 100 000-szeres nagyítással.
Mind a fotonok, mind az elektronok és más részecskék hullám- és korpuszkuláris tulajdonságainak jelenléte lehetővé teszi az optika számos rendelkezésének és törvényének kiterjesztését a töltött részecskék elektromos és mágneses térben történő mozgásának leírására.
Ez a hasonlat lehetővé tette, hogy önálló szakaszként különítsük el elektronikus optika - a fizika olyan területe, amelyben az elektromos és mágneses mezőkkel kölcsönhatásba lépő töltött részecskék nyalábjainak szerkezetét tanulmányozzák. A hagyományos optikához hasonlóan az elektronikus is felosztható geometriai (gerenda) és hullám(fizikai).
A geometriai elektronoptika keretében különösen a töltött részecskék mozgását írják le elektromos és mágneses térben. A képalkotás elektronmikroszkópos sematikus ábrázolása (lásd 28.2. ábra, b) geometriai elektronoptikán alapul.
A hullámelektronoptika megközelítése elengedhetetlen abban az esetben, ha a töltött részecskék hullámtulajdonságai megnyilvánulnak. Jó példa erre, ha megtaláljuk a bekezdés elején megadott felbontást (felbontási határt).
28.3. HULLÁMFUNKCIÓ ÉS FIZIKAI JELENTÉSE
Mivel a mikrorészecskék a mozgásának megfelelő hullámfolyamathoz kapcsolódnak, a részecskék állapotát a kvantummechanikában egy koordinátáktól és időtől függő hullámfüggvény írja le: ψ(χ, y, z, t).
Ha a részecskére ható erőtér stacioner, azaz. időtől függetlenül, akkor a ψ-függvény két tényező szorzataként ábrázolható, amelyek közül az egyik az időtől, a másik a koordinátáktól függ:
A továbbiakban csak a stacionárius állapotokat fogjuk figyelembe venni; A ψ-függvény egy részecske állapotának valószínűségi jellemzője. Magyarázzuk meg ennek az állításnak a jelentését.
Helyezzünk el egy kellően kis térfogatot a térben dV= dxdjdz, amelyen belül a ψ-függvény értékei azonosnak tekinthetők. A megtalálás valószínűsége dW B A részecskék mennyisége ebben a térfogatban arányos a térfogattal, és a ψ-függvény modulusának négyzetétől függ:

A hullámfüggvény modulusának négyzete egyenlő a valószínűségi sűrűséggel, azaz. annak a valószínűségének aránya, hogy egy térfogatban részecskét találunk ehhez a térfogathoz képest.
A (28.6) kifejezést valamilyen V térfogatra integrálva megtaláljuk annak a valószínűségét, hogy ebben a kötetben részecskét találunk:
28.4. BIZONYTALANSÁGI KAPCSOLATOK
A kvantummechanika egyik fontos rendelkezése a W. Heisenberg által javasolt bizonytalansági viszonyok.
Legyen a részecske helyzetének és impulzusának mérése egyidejűleg, míg az abszcissza definícióiban és az impulzus abszcissza tengelyre vetítésében a pontatlanság Δχ, illetve Δр x.

1 Valóban lehetetlen ilyen kísérletet végrehajtani, mivel a rés méretei atomok nagyságrendűek kell, hogy legyenek, ezért valamilyen mentális kísérletet írnak le.

A (28.11) megoldás azt jelenti, hogy minél rövidebb a rendszer bármely állapotának fennállási ideje, annál bizonytalanabb az energiaértéke. Energiaszintek E 1 , E 2 stb. bizonyos szélességűek (28.6. ábra), attól függően, hogy a rendszer mennyi ideig van ennek a szintnek megfelelő állapotban.
A szintek „elmosódása” a kibocsátott foton AE energiájának és Ay frekvenciájának bizonytalanságához vezet a rendszer egyik energiaszintről a másikra való átmenete során:
Mivel a mikrorészecskék állapotát a ψ-függvény írja le, ezért a külső körülmények figyelembevételével meg kell adni a függvény megtalálásának módját. Ez az E. Schrödinger (1926) által javasolt kvantummechanikai alapegyenlet megoldásának eredményeként lehetséges. Egy ilyen egyenletet a kvantummechanika ugyanúgy feltételez, mint Newton második törvényét a klasszikus mechanikában.
Stacionárius állapotokra alkalmazva a Schrödinger-egyenlet a következőképpen írható fel:
Ez a spektrumvonalak kiszélesedésében nyilvánul meg.
28.5. SCHROEDINGER EGYENLET. ELEKTRON EGY POTENCIÁLIS KÚTBAN
ahol m- részecsketömeg; Eés E p a teljes és potenciális energiája (a potenciális energiát az az erőtér határozza meg, amelyben a részecske található, és stacionárius esetben nem függ az időtől).
Ha a részecske csak valamilyen vonal mentén mozog, például a tengely mentén x(egydimenziós eset), akkor a Schrödinger-egyenlet jelentősen leegyszerűsödik, és a következő alakot ölti:
A Schrödinger-egyenlet alkalmazásának egyik legegyszerűbb példája az egydimenziós potenciálkútban lévő részecske mozgásának problémájának megoldása.
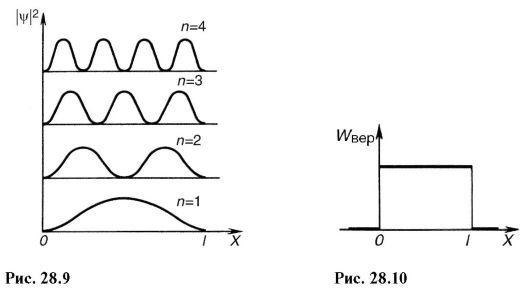
Hagyja, hogy az elektron a tengely mentén mozogjon x csak 0-n belül< x < l(28.7. ábra). Ez azt jelenti, hogy a jelzett intervallumban a ψ-függvény nem nulla, és az intervallumon kívül (x<0, x>l) egyenlő nullával.
Mivel az erőterek nem hatnak a részecskére a kiválasztott intervallumban, potenciális energiája tetszőleges állandó értékű lehet (legkényelmesebb venni E p= 0). Ezen az intervallumon kívül nincs elektron, ezért potenciális energiáját végtelenül nagynak kell tekinteni. ábrán A 28.7. ábra E p \u003d D x) grafikus függését mutatja. 0. intervallum< x < l, удовлетворяющий сформулированным выше условиям, называют одномерной прямоугольной potenciális lyuk végtelenül magas falakkal. Számításba vesz E p= 0 Schrödinger-egyenlet (28.14) a 0. intervallumhoz< x < lúgy néz ki, mint a:

Ez az egyenlet hasonló differenciálegyenlet harmonikus rezgés (lásd 7.1), amelynek megoldása:

Mindenekelőtt figyelemre méltó, hogy a Schrödinger-egyenlet megoldása egy elektronra egy potenciálkútban minden további posztulátum nélkül diszkrét, kvantált energiaértékekhez vezet:

A (28.21)-ből látható, hogy valamilyen fix értékre n diszkrétség, azaz. a szomszédos szintek energiáinak különbsége minél kisebb, minél nagyobb a potenciálkút mérete. Vegyünk például két esetet n = 1:
1) l= 5? 10-10 m, ami nagyjából egy atom méretének felel meg; azután ΔΕ = 4,5 eV. Ez nagyságrendileg egybeesik a hidrogénatom Bohr elmélete szerint kapott értékeivel;
2) l= 10 -1 m, ami tulajdonképpen a potenciálkút olyan szélességének felel meg, hogy az elektron szabadnak tekinthető; ahol ΔΕ = 1.1? 10 -16 eV. Itt a diszkrétség elhanyagolható, és gyakorlatilag az elektronenergia folyamatos változásának tekinthető.
A (28,20) négyzetre emelve megkapjuk a |ψ| valószínűségi sűrűséget 2 elektron megtalálása a potenciálkút különböző pontjain. ábrán A 28.9 a |ψ| grafikus függést mutatja 2 off χ különböző diszkrét állapotokban, pl. különböző kvantumszámok. Amint az ábrán látható, egy elektron különböző valószínűséggel lehet a potenciálkút különböző helyein. Vannak olyan pontok, ahol az elektron megtalálásának valószínűsége általában egyenlő nullával. Ez jelentősen eltér a klasszikus fizika elképzeléseitől, miszerint egyformán valószínű, hogy egy részecske a potenciálkút különböző helyein helyezkedik el (28.10. ábra), és lehetetlen a kutat olyan pontokkal felosztani, amelyekben részecske kizárva.
A Schrödinger-egyenlet bonyolultabb erőterekre is alkalmazható, például egy elektronra az atomban. Ez további matematikai nehézségekhez vezet, de nem változtatja meg a fő jellemzőket.
atomi rendszerek: energiaállapotok diszkrétsége, valószínűségi ítéletek az elektron megtalálásáról, egyfajta függőség |ψ| 2 koordinátákból stb.
28.6. A SCHROEDINGER-EGYENLET ALKALMAZÁSA HIDROGÉNATOMRA. KVANTUMSZÁMOK
Az atomok és molekulák állapotának leírása a Schrödinger-egyenlettel meglehetősen nehéz feladat. A legegyszerűbben az atommag mezőjében elhelyezkedő elektronra oldható meg. Az ilyen rendszerek a hidrogénatomnak és a hidrogénszerű ionoknak felelnek meg (egyszer ionizált hélium atom, kétszeresen ionizált lítium atom stb.). Ebben az esetben azonban a probléma megoldása túlmutat tantárgyunk keretein, így a probléma kvalitatív bemutatására szorítkozunk.
Mindenekelőtt a potenciális energiát be kell cserélni a (28.13) Schrödinger-egyenletbe, amely két kölcsönhatásban lévő ponttöltésre - e(elektron) és Ze(mag), - távolabb található r vákuumban a következőképpen fejeződik ki:
Az atommag által létrehozott mező centrális szimmetriájával kényelmesebb a feladat megoldása nem derékszögű derékszögű koordinátákkal, hanem gömb alakú r, θ és p értékekkel.
A Schrödinger-egyenlet megoldását három függvény szorzataként találjuk meg, amelyek mindegyike egy változótól függ:
Csakúgy, mint egy végtelenül magas falú téglalap alakú potenciálkútban lévő elektron esetében határviszonyok a ψ és az energia adott lehetséges értékeihez vezettek, a hidrogénatomnak megfelelő potenciálkútban pedig a fizikai körülmények az f1 lehetséges értékeihez vezetnek, f 2, f 3és ebből ψ-függvények. Itt a kvantummechanikai rendszerek fő jellemzője is megnyilvánul - az állapotok diszkrétsége.
A diszkrétség matematikailag abban rejlik, hogy a (28.23) egyenlet bármelyik függvényének van egy teljes megoldáshalmaza (spektruma), amelyek mindegyike egy adott kvantumszámnak felel meg. A végtelenül magas falú téglalap alakú potenciálkúttól eltérően az atomban lévő elektron állapotát nem egy, hanem több kvantumszám 1 jellemzi. Az első közülük - főkvantumszám P - 1, 2, 3... Meghatározza az elektron energiaszintjét a törvény szerint:

Ez a kifejezés a Schrödinger-egyenlet megoldása, és teljes mértékben egybeesik Bohr elméletének megfelelő képletével (lásd 28.7).
ábrán A 28.11 a hidrogénatom összenergiájának lehetséges értékeinek szintjeit (E 1, E 2, E 3 stb.) és a függőségi grafikont mutatja helyzeti energia E P távolról r elektron és atommag között [lásd (28.22)]. Ahogy a főkvantumszám növekszik P növeli r[lásd például (28.33)], és a teljes [lásd. (28.24)] és a potenciális energia nullára hajlik. Kinetikus energia nullára is hajlik. Az árnyékolt terület (E > 0) a szabad elektron állapotának felel meg.
1 A kvantumszámok általában egész számok (0, 1, 2...) vagy félegészek (1/2, 3/2, 5/2...) számok, amelyek meghatározzák a lehetséges diszkrét értékeket. fizikai mennyiségek, amelyek a kvantumrendszereket és az elemi részecskéket jellemzik.

1 A részecskékben lévő spin jelenléte nem következik a Schrödinger-egyenletből.
ezzel a számítással: nagyobb valószínűségű helyeken több idő volt, kisebb valószínűségű helyeken kevésbé hosszú. A filmre való exponálás eredményeként különböző intenzitású helyeket kaptunk, amelyek az elektron eloszlását szemléltetik egy atomban. Az ábrákon jól látható, hogy a „pálya” fogalma mennyire feltételes, sőt helytelen az elektron mozgásával kapcsolatban.
A spin és az orbitális mágneses momentumok kölcsönhatásba lépnek egymással, ez megváltoztatja az atom energiaszint-rendszerét ahhoz képest, amelyik ilyen kölcsönhatás nélkül lenne. Azt mondják, hogy a spin-pálya kölcsönhatás oda vezet finom szerkezet energiaszintek. Ha jelentős, akkor figyelembe kell venni az elektron teljes szögimpulzusát - orbitális plusz spin. Eközben ahelyett m lÉs Kisasszony használj más kvantumszámokat: jÉs nij.
j kvantumszám- orbitális plusz spin - meghatározza a teljes szögimpulzus diszkrét értékeit L elektron:

Mágneses kvantumszám m) jellemzi a teljes szögimpulzus lehetséges vetületeit valamilyen tetszőlegesen választott irányra Z:
Adottnak l kvantumszám j két értéket vesz fel: ±1/2
(28.1. táblázat).
28.1. táblázat

Adottnak j kvantumszám nij 2j + 1 értéket vesz fel: -j, -j + 1 ... + j.
28.7. A BÓR ELMÉLETÉNEK FOGALMA
N. Bohr dán fizikus még a kvantummechanika 1913-as megalkotása előtt javasolta a hidrogénatom és a hidrogénszerű ionok elméletét, amely az atom magmodelljén és annak két posztulátumán alapult. Bohr posztulátumai nem illeszkedtek a klasszikus fizika keretei közé.
Az első posztulátum szerint egy atom és az atomrendszerek csak bizonyos stacionárius állapotokban maradhatnak meg sokáig. Ilyen állapotban az atom nem bocsát ki és nem vesz fel energiát. Az álló állapotok diszkrét energiaértékeknek felelnek meg: E 1, E 2...
Egy atom vagy atomi rendszer energiájában bekövetkező bármilyen változás az egyik álló állapotból a másikba való hirtelen átmenethez kapcsolódik.
A második posztulátum szerint az atom egyik állapotból a másikba való átmenete során az atom egy fotont bocsát ki vagy nyel el, melynek energiáját a (29.1) egyenlet határozza meg.
A nagyobb energiájú állapotból az alacsonyabb energiájú állapotba való átmenet foton emisszióval jár együtt. A fordított folyamat lehetséges, ha egy foton elnyelődik.
Bohr elmélete szerint a hidrogénatom elektronja körpályán kering az atommag körül. Az összes lehetséges pálya közül az álló állapotok csak azoknak felelnek meg, amelyeknél a szögimpulzus egész szám h/(2π):
(n = 1, 2, 3...), (28,31)
ahol m- elektrontömeg; υ η - sebessége bekapcsolva n-edik pálya; rn a sugara. Az atomban körpályán forgó elektronra a pozitív töltésű atommag oldaláról a Coulomb-vonzóerő hat, amely Newton második törvénye szerint egyenlő az elektron tömegének szorzatával. centripetális gyorsulás(a vákuumra vonatkozó rekord):

Bohr elméletének nagy sikere ellenére hamarosan nyilvánvalóvá váltak hiányosságai. Így ennek az elméletnek a keretein belül nem lehetett megmagyarázni a spektrumvonalak intenzitásának különbségét, i.e. válaszoljon arra a kérdésre, hogy bizonyos energiaátmenetek miért valószínűbbek, mint mások. Bohr elmélete nem fedte fel egy bonyolultabb atomrendszer - a héliumatom (két elektron kering a mag körül) - spektrális mintázatait.
Bohr elméletének hátránya a következetlensége volt. Ez az elmélet nem volt sem klasszikus, sem kvantum, alapvetően különböző elméletek rendelkezéseit egyesítette: a klasszikus és a kvantumfizikát. Így például Bohr elméletében úgy gondolják, hogy az elektron egy atomban egy bizonyos pályán forog (klasszikus ábrázolások), de nem bocsát ki elektromágneses hullámot (kvantumreprezentációk).
Századunk első negyedében világossá vált, hogy Bohr elméletét egy másik atomelméletre kell felváltani. Megjelent a kvantummechanika.
28.8. KOMPLEX ATOMOK ELEKTRONIKUS HÉJAI
A hidrogénatomban lévő elektronok állapotát leíró kvantumszámok segítségével közelítjük meg az egyes elektronok állapotát komplex atomokban. Mindazonáltal figyelembe kell venni legalább két jelentős különbséget a komplex atomok és a hidrogénatom között:
1) összetett atomokban az elektronok energiája kölcsönhatásuk miatt nemcsak n-től, hanem /-től is függ;
2) a különbség a Pauli-elvből adódik, amely szerint egy atomnak nem lehet két (vagy több) négy azonos kvantumszámú elektronja.
A normál állapotnak megfelelő elektronikus konfiguráció kialakítása során az atom minden egyes elektronja a legalacsonyabb energiájú. Ha nem lenne Pauli-elv, akkor minden elektron a legalacsonyabb energiaszinten helyezkedne el. Valójában néhány kivételtől eltekintve az elektronok azt az állapotsort foglalják el, amelyet a hidrogénatom a táblázatban jelez. 29.
Az azonos főkvantumszámú elektronok réteget alkotnak. A rétegeket ún NAK NEK, L M, N stb. vminek megfelelően n= 1, 2, 3, 4... Azonos értékpárral rendelkező elektronok nÉs / , a héj részei, amelyet röviden ugyanúgy jelölünk, mint a hidrogénatom elektronjának megfelelő állapotait: 1s, 2s, 2^ stb. Így például a 2s héjat, a 2s elektronokat stb.
A héjban lévő elektronok száma a jobb felső sarokban látható a héj szimbolikus jelölése mellett, például 2p 4 .
Az elektronok héjakon való eloszlását egy atomban (elektronikus konfigurációk) általában a következőképpen jelölik: nitrogén esetében 1s 2, 2s2, 2p 3, kalcium esetén 1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2 stb.
Mivel az összetett atomok elektronjainak energiája nemcsak n-től függ, hanem attól is l, akkor a periódusos rendszer felépítése nem mindig a rétegek fokozatos kitöltésével történik, ahogy az atom bonyolultabbá válik. A káliumhoz (Z = 19) például a réteg feltöltése helyett M(lehetne 1s 2 , 2s 2 , 2^ 6 , 3s 2 , 3p 6, 3a 1) megkezdődik a réteg feltöltése Nés a következő elektronikus konfiguráció jön létre: 1 s2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 1.
Más elemek is hasonló eltéréseket mutatnak a rétegek szabályos kitöltésétől.
Az általános szabály mindig teljesül: a gerjesztetlen atom elektronjai a legalacsonyabb energiájú állapotot foglalják el, a Pauli-elvnek megfelelően. ábrán A 28.13. ábrán sematikusan, a skála figyelembevétele nélkül, egy komplex atom energiaállapotai és a megfelelő elektronok száma látható.
Végezetül megjegyezzük, hogy a többelektronos atom állapotát a következő kvantumszámok határozzák meg: L- az atom teljes keringési impulzusa, amely a 0, 1, 2, 3 stb. értékeket veszi fel. egy ; J- az atom teljes momentuma, amely |L-től egyes intervallumban vehet fel értékeket S| hogy |L + S |; S- az atom eredő spinmomentuma; mágneses m J , amely meghatározza az atom teljes impulzusának valamilyen tengelyre vetítésének diszkrét értékeit Z:

Adottnak Jm J vesz 2 J+ 1 értékek:
-J, -J+ 1 ... +J.
1 Ne keverje össze ezt a megjelölést az elektronikus réteg nevével Lés az elektron teljes impulzusimpulzusával.
28.9. A MOLEKULÁK ENERGIASZINTJE
Mivel a molekulák atomokból állnak, az intramolekuláris mozgás bonyolultabb, mint az atomon belüli mozgás. A molekulában az elektronok atommagokhoz viszonyított mozgásán túlmenően, oszcilláló mozgás egyensúlyi helyzetük körüli atomok (az atommagok rezgése az őket körülvevő elektronokkal együtt) és a molekula egészének forgási mozgása.
Elektronikus, oszcillációs és forgó mozgások A molekulák háromféle energiaszintnek felelnek meg: E el, E count és E time. A kvantummechanika szerint egy molekulában minden típusú mozgás energiája csak diszkrét értékeket vesz fel (kvantált). Közelítőleg ábrázoljuk a molekula teljes E energiáját különböző típusú energiák kvantált értékeinek összegeként:
E\u003d E el + E szám + E idő. (28.37)
ábrán A 28.14 sematikusan ábrázolja egy molekula szintrendszerét: távoli elektronikus energiaszintek de"És de"", amelyre E count = E vr = 0; közelebbi rezgésszintek v" , v"", számukra E r = 0; a legközelebbi forgási szintek J"És J"" különböző E idő értékekkel.
Az elektronikus energiaszintek közötti távolság több elektronvolt nagyságrendű, a szomszédos rezgésszintek között 10 -2 -10 -1 eV, a szomszédos forgási szintek között 10 -5 -10 -3 eV.

Persze lehet hülyeségnek is nevezni,
de találkoztam olyan ostobasággal, hogy in
hozzá képest ez ésszerűnek tűnik
szótár.
L. Carroll
Mi az atom bolygómodellje és mi a hátránya? Mi a lényege az atom Bohr-modelljének? Mi a hipotézis a részecskék hullámtulajdonságairól? Milyen előrejelzéseket ad ez a hipotézis a mikrovilág tulajdonságairól?
Óra-előadás
AZ ATOM KLASSZIKUS MODELLEI ÉS HÁTRÁNYAI. Az a gondolat, hogy az atomok nem oszthatatlan részecskék, és alkotórészecskeként elemi töltéseket tartalmaznak, a 19. század végén fogalmazták meg először. Az "elektron" kifejezést George Stoney angol fizikus javasolta 1881-ben. 1897-ben az elektronikus hipotézis kísérleti megerősítést kapott Emil Wiechert és Joseph John Thomson tanulmányaiban. Ettől a pillanattól kezdve megkezdődött az atomok és molekulák különféle elektronikus modelljeinek létrehozása.
Thomson első modellje azt feltételezte, hogy a pozitív töltés egyenletesen oszlik el az atomban, és elektronok vannak benne, mint a mazsola a zsemlében.
A modell és a kísérleti adatok közötti eltérés világossá vált Ernest Rutherford 1906-os kísérlete után, aki az α-részecskék atomok általi szórásának folyamatát tanulmányozta. A tapasztalatok alapján arra a következtetésre jutottak, hogy a pozitív töltés a képződmény belsejében koncentrálódik, sokkal kisebb, mint az atom mérete. Ezt a formációt ún atommag, melynek méretei 10 -12 cm, az atom méretei - 10 -8 cm Az elektromágnesesség klasszikus elképzeléseinek megfelelően a Coulomb-vonzóerőnek kell hatnia az egyes elektronok és az atommag között. Ennek az erőnek a távolságtól való függésének meg kell egyeznie az egyetemes gravitáció törvényével. Ezért az elektronok mozgásának egy atomban hasonlónak kell lennie a Naprendszer bolygóinak mozgásához. Szóval megszületett az atom bolygómodellje Rutherford.
Az atom rövid élettartama és a folytonos sugárzási spektrum, amely a bolygómodellből következik, azt mutatta, hogy az elektronok mozgásának leírásában nem következetes az atomban.
Az atom stabilitásának további vizsgálata döbbenetes eredményt hozott: a számítások azt mutatták, hogy 10 -9 s idő alatt az elektronnak az atommagra kell esnie a sugárzási energiaveszteség miatt. Ezenkívül egy ilyen modell folytonos, nem pedig diszkrét emissziós spektrumot adott az atomoknak.
BÓRATOM ELMÉLET. Az atomelmélet fejlesztésének következő fontos lépését Niels Bohr tette meg. A Bohr által 1913-ban felvetett legfontosabb hipotézis az atomban lévő elektron energiaszintjének diszkrét szerkezetére vonatkozó hipotézis volt. Ezt a helyzetet az energiadiagramok szemléltetik (21. ábra). Hagyományosan az energiadiagramok az energiát a függőleges tengely mentén ábrázolják.
Rizs. 21 Műhold energia a Föld gravitációs mezőjében (a); elektron energiája egy atomban (b)
A test gravitációs térben való mozgása (21. ábra a) és az elektron mozgása az atomban (21. ábra, b) között a különbség a Bohr-hipotézis szerint az, hogy a test energiája folyamatosan képes változás, és egy negatív értékű elektron energiája az ábrán látható diszkrét soros értékeket kék szegmensként veheti fel. Ezeket a diszkrét értékeket energiaszinteknek vagy más szóval energiaszinteknek nevezték.
Természetesen a diszkrét energiaszintek ötlete Planck hipotéziséből származott. Az elektron energiájának változása Bohr elméletének megfelelően csak egy ugrás során következhet be (egyik energiaszintről a másikra). Ezen átmenetek során fénykvantumot bocsátanak ki (lefelé történő átmenet) vagy abszorbeálnak (felfelé történő átmenet), amelynek frekvenciáját az atom Planck-képlete határozza meg: hv \u003d E kvantum \u003d ΔE, azaz az atom energiájának változása. az atom arányos a kibocsátott vagy elnyelt fénykvantum frekvenciájával.
Bohr elmélete tökéletesen megmagyarázta az atomspektrumok vonaljellegét. Az elmélet azonban valójában nem adott választ arra a kérdésre, hogy mi az oka a szintek diszkrétségének.
AZ ANYAG HULLÁMAI. A mikrovilág elméletének kidolgozásának következő lépését Louis de Broglie tette meg. 1924-ben azt javasolta, hogy a mikrorészecskék mozgását ne klasszikusnak nevezzük mechanikus mozgás, hanem valamiféle hullámmozgásként. A különböző megfigyelhető mennyiségek kiszámításához a hullámmozgás törvényeiből kell recepteket szerezni. Tehát a tudományban az elektromágneses mező hullámaival együtt megjelentek az anyag hullámai is.
A részecskék mozgásának hullámtermészetére vonatkozó hipotézis ugyanolyan merész volt, mint Planck hipotézise a mező diszkrét tulajdonságairól. Csak 1927-ben állítottak fel egy kísérletet, amely közvetlenül megerősítette de Broglie hipotézisét. Ebben a kísérletben az elektromágneses hullám diffrakciójához hasonló elektrondiffrakciót figyeltek meg egy kristályon.
Bohr elmélete fontos lépés volt a mikrovilág törvényeinek megértésében. Ez volt az első, amely bevezette az atomban lévő elektron energiájának diszkrét értékeire vonatkozó rendelkezést, amely megfelelt a tapasztalatnak, és később a kvantumelmélet részévé vált.
Az anyaghullámok hipotézise lehetővé tette az energiaszintek diszkrét jellegének magyarázatát. A hullámelméletből ismert volt, hogy a térben korlátozott hullámnak mindig diszkrét frekvenciája van. Ilyen például a hullám egy hangszerben, például a fuvolában. A hangfrekvenciát ebben az esetben annak a térnek a méretei határozzák meg, amelyre a hullám korlátozódik (a fuvola méretei). Kiderült, hogy ez a hullámok általános tulajdonsága.
De Planck hipotézisének megfelelően az elektromágneses hullám kvantumának frekvenciája arányos a kvantum energiájával. Következésképpen az elektronenergiának is diszkrét értékeket kell felvennie.
De Broglie ötlete nagyon gyümölcsözőnek bizonyult, bár, mint már említettük, az elektron hullámtulajdonságait megerősítő közvetlen kísérletet csak 1927-ben végeztek. A hidrogénatom minden olyan eredményt kapott, amire Bohr elmélete képes volt. adva. Valójában ez volt a kezdete egy modern elméletnek, amely leírja a mikrovilág folyamatait, mivel a hullámegyenletet könnyen általánosították különféle rendszerekre - sokelektronos atomokra, molekulákra, kristályokra.
Az elmélet fejlődése annak megértéséhez vezetett, hogy a részecskének megfelelő hullám határozza meg a részecske megtalálásának valószínűségét a tér adott pontjában. Így a valószínűség fogalma bekerült a mikrokozmosz fizikájába
Az új elmélet szerint a részecskének megfelelő hullám teljes mértékben meghatározza a részecske mozgását. De a hullámok általános tulajdonságai olyanok, hogy egy hullám a tér egyetlen pontján sem lokalizálható, vagyis értelmetlen egy részecske koordinátáiról beszélni egy adott időpillanatban. Ennek következménye az volt, hogy a mikrokozmosz fizikájából teljesen kizárták az olyan fogalmakat, mint a részecske pályája és az elektron keringése egy atomban. Az atom gyönyörű és látványos bolygómodellje, mint kiderült, nem felel meg az elektronok valós mozgásának.
A mikrokozmoszban minden folyamat valószínűségi jellegű. Számításokkal csak egy adott folyamat bekövetkezésének valószínűségét lehet meghatározni.
Befejezésül térjünk vissza az epigráfiához. Az anyaghullámokkal és a mezőkvantumokkal kapcsolatos hipotézisek értelmetlennek tűntek sok fizikus számára, akik a klasszikus fizika hagyományaira nevelkedtek. A tény az, hogy ezek a hipotézisek meg vannak fosztva attól a szokásos vizualizációtól, amellyel a makrokozmoszban végzett megfigyelések során rendelkezünk. A mikrovilág tudományának ezt követő fejlődése azonban olyan gondolatokhoz vezetett, amelyek ... (lásd a bekezdés epigráfiáját).
- Milyen kísérleti tényeknek mondott ellent Thomson atommodellje?
- Mi maradt meg a Bohr-féle atommodellből a modern elméletben, és mi az, amit elvetettek?
- Milyen gondolatok járultak hozzá de Broglie hipotéziséhez az anyag hullámairól?