Dualitate undă-particulă- proprietatea oricărei microparticule de a detecta semnele unei particule (corpuscul) și ale unei unde. Dualismul undelor corpusculare se manifestă cel mai clar în particulele elementare. Un electron, neutron, foton se comportă în anumite condiții ca obiecte materiale (particule) bine localizate în spațiu, mișcându-se cu anumite energii și momente de-a lungul traiectoriilor clasice, iar în alte condiții se comportă ca undele, ceea ce se manifestă prin capacitatea lor de a interfera și de a difracție. . Deci, o undă electromagnetică, care se împrăștie pe electroni liberi, se comportă ca un flux de particule individuale - fotoni, care sunt cuante ale câmpului electromagnetic (efectul Compton), iar impulsul fotonului este dat de formula p \u003d h / λ , unde λ este lungimea undei electromagnetice, iar h este constanta lui Planck. Această formulă în sine este o dovadă a dualismului. În el, în stânga este impulsul unei particule individuale (foton), iar în dreapta este lungimea de undă a fotonului. Dualismul electronilor, pe care suntem obișnuiți să-l considerăm particule, se manifestă prin faptul că atunci când este reflectat de pe suprafața unui singur cristal, se observă un model de difracție, care este o manifestare a proprietăților undei electronilor. Relația cantitativă dintre caracteristicile corpusculare și de undă ale unui electron este aceeași ca și pentru un foton: р = h/λ (р este impulsul electronului, iar λ este lungimea sa de undă de Broglie). Dualitatea undă-particulă stă la baza fizică cuantică.
O undă (blană) este un proces care este întotdeauna asociat cu un mediu material care ocupă un anumit volum în spațiu.
64. Waves de Broglie. Difracția electronilor Proprietățile undei ale microparticulelor.
Dezvoltarea ideilor despre proprietățile corpusculare ale materiei primite în ipoteza naturii ondulatorii a mișcării microparticulelor. Louis de Broglie, de la ideea de simetrie în natură pentru particulele de materie și lumină, a atribuit oricărei microparticule un proces periodic intern (1924). Combinând formulele E = hν și E = mc 2 , a obținut o relație care arată că orice particulă are propria sa lungime de undă : λ B \u003d h / mv \u003d h / p, unde p este impulsul particulei-undă. De exemplu, pentru un electron care are o energie de 10 eV, lungimea de undă de Broglie este de 0,388 nm. Mai târziu s-a demonstrat că starea unei microparticule în mecanica cuantică poate fi descrisă de un anumit complex funcția de undă coordonatele Ψ(q), și pătratul modulului acestei funcții |Ψ| 2 definește distribuția de probabilitate a valorilor coordonatelor. Această funcție a fost introdusă pentru prima dată în mecanica cuantică de către Schrodinger în 1926. Astfel, unda de Broglie nu transportă energie, ci doar reflectă „distribuția de fază” a unui proces periodic probabilistic în spațiu. Prin urmare, descrierea stării obiectelor microlumii este caracter probabilistic, spre deosebire de obiectele macrocosmosului, care sunt descrise de legile mecanicii clasice.
Pentru a demonstra ideea lui de Broglie despre natura ondulatorie a microparticulelor, fizicianul german Elsasser a sugerat utilizarea cristalelor pentru a observa difracția electronilor (1925). În SUA, K. Davisson și L. Germer au descoperit fenomenul de difracție în timpul trecerii unui fascicul de electroni printr-o placă de cristal de nichel (1927). Independent de ei, difracția electronilor la trecerea printr-o folie metalică a fost descoperită de J.P.Thomson în Anglia și P.S. Tartakovsky în URSS. Deci ideea lui de Broglie despre proprietățile undei ale materiei a găsit confirmare experimentală. Ulterior, proprietățile difractive și, prin urmare, ondulatorii au fost descoperite în fasciculele atomice și moleculare. Proprietățile undelor corpusculare sunt posedate nu numai de fotoni și electroni, ci și de toate microparticulele.
Descoperirea proprietăților de undă ale microparticulelor a arătat că forme de materie precum câmpul (continuu) și materia (discretă), care, din punctul de vedere al fizicii clasice, erau considerate calitativ diferite, în anumite condiții pot prezenta proprietăți inerente ambelor. forme. Aceasta vorbește despre unitatea acestor forme de materie. O descriere completă a proprietăților lor este posibilă numai pe baza unor idei opuse, dar complementare.
MODELE CLASICE ALE ATOMULUI SI DEFECTELE LOR.
Idei despre ce atomii nu sunt particule indivizibile și conțin ca constituenți
sarcinile elementare ale particulelor, au fost menționate mai întâi la sfârșitsecolul al 19-lea Termenul de „electron” a fost propus în 1881 de către fizicianul englez GeorgeStoney. În 1897, ipoteza electronului a primit un experimentconfirmare în studiile lui Emil Wiechert și Joseph Jan Thomson. Din acel moment a început crearea diferitelor modele electronice.atomi și molecule.Primul model al lui Thomson presupunea că sarcina pozitivă este uniformădispersate prin atom și în el, ca stafidele într-o chiflă,electroni încorporați.Inconsecvența acestui model cu datele experimentale a devenit clarădupă un experiment din 1906 al lui Ernest Rutherford, care a investigat
procesul de împrăștiere a particulelor a de către atomi. Din experiență ai fost făcut,că sarcina pozitivă este concentrată în interiorul formațiunii, este esențialmai mic decât dimensiunea unui atom. Această formațiune a fost numită atomicănucleu, ale cărui dimensiuni au fost 1 o-12 cm, iar dimensiunile atomului au fost 1 o-in cm.
În conformitate cu conceptele clasice de electromagnetismtrebuie să acționeze o forță Coulomb între fiecare electron și nucleuatracţie. Dependența acestei forțe de distanță ar trebui să fiela fel ca in lege gravitatie. Prin urmare, mișcarea
electronii dintr-un atom ar trebui să fie caci mişcarea planetelor sistem solar. Astfel s-a născut modelul planetaratomul Rutherford.Explorarea în continuare a durabilitățiiatom a dat un rezultat uimitor:calculele au arătat că în timpul1 o-9 s electronul trebuie să cadă pe nucleu
datorita pierderii de energie prin radiatii. Mai mult, acest model a datspectre de emisie continue mai degrabă decât discrete ale atomilor.
TEORIA ATOMILOR DE BUR.
Următorul pas importantîn dezvoltarea teoriei atomilor a fost făcută de Niels Bohr.
Cea mai importantă ipoteză propusă de Bohr în 1913, a apărut ipoteza unei structuri discrete
nivelurile de energie ale unui electron dintr-un atom. Această poziție ilustrat pe energie
diagrame. În mod tradițional, energie diagrame, energia se depune de-a lungul verticalei
topoare. Diferența dintre mișcarea unui corp într-un câmp gravitaționaldin mișcarea unui electron într-un atomconform ipotezei Bohr estecă energia unui corp se poate schimba continuu,iar energia electronilor la valori negativepoate lua o serie de valori discrete,prezentate în figură ca segmente albastreculorile. Aceste valori discrete au fost numiteniveluri de energie sau, în caz contrar, energie niveluri. Desigur, ideea nivelurilor de energie discretea fost preluat din ipoteza lui Planck. Schimbarea energieielectron în conformitate cu teoria lui Bohr ar puteaapar doar într-un salt (de la un nivel de energie o alta). Teoria lui Bohr a explicat perfect caracterul liniei
spectre atomice. Cu toate acestea, la întrebarea despre motivul discretității
niveluri, teoria nu a dat de fapt un răspuns.
UNDE DE SUBSTANȚĂ.
Următorul pas în dezvoltarea teoriei microlumilor a fost realizat de Louis de Broglie. În 1924 el a sugerat cămișcarea microparticulelor trebuie descrisă nu ca fiind mecanică clasică
mișcare, ci ca un fel de mișcare a valurilor. Este din legi mișcarea valurilor trebuie obținute rețete pentru calcularea diferențeloralte mărimi observabile. Deci în știință, împreună cu undele electromagneticecâmpuri au apărut valuri de materie.Ipoteza despre natura ondulatorie a mișcării particulelor a fost la fel de îndrăzneață caprecum şi conjectura lui Planck despre proprietăţile discrete ale câmpului. Experiment,confirmând direct ipotezaBroglie, a fost livrat abia în 1927.În acest experiment s-a observatdifracția electronilor pe un cristal,precum difracția electromagnetică valuri. Ipoteza despre undele de materie a permisexplica natura discreta
niveluri de energie. Din teorie valuri, se știa că un val limitat în spațiu are întotdeaunafrecvente discrete. Un exemplu este un val într-un astfel de musicalinstrument ca un flaut. Frecvența sunetului în acest caz este determinatădimensiunile spațiului de care este limitată valul (dimensiunile flautului).Se pare că aceasta este o proprietate generală a undelor.Dar în conformitate cu ipoteza lui Planck, frecvența cuantică electromagneticăundele sunt proporţionale cu energia cuantumului. Prin urmare, energia electronuluitrebuie să ia valori discrete.Ideea lui De Broglie s-a dovedit a fi foarte fructuoasă, deși, așa cum am menționat deja,experiment direct care confirmă proprietățile de undă ale unui electron, a fost realizat abia în 1927. În 1926, Erwin Schrödinger a derivat ecuația,căruia trebuie să se supună unda de electroni și, după ce am rezolvat acest lucruecuația aplicată atomului de hidrogen, a primit toate rezultatele carea fost capabil să dea teoria lui Bohr. De fapt, acesta a fost începutulteoria modernă descrierea proceselor din microcosmos, deoareceecuația de undă a fost ușor generalizată pentru o varietate de sisteme - cu mulți electroniatomi, molecule, cristale.Dezvoltarea teoriei a condus la înțelegerea că unda îi corespundeparticulă, determină probabilitatea de a găsi o particulă într-un punct datspaţiu. Astfel, conceptul de probabilitate a intrat în fizica microlumilor.Conform noua teorie unda corespunzătoare particulei determină completmișcarea particulelor. Dar proprietățile generale ale undelor sunt de așa natură încât valulnu poate fi localizat în niciun punct al spațiului, adică fără înţelesvorbiți despre coordonatele particulei la un moment dat.Consecința acestui lucru a fost excluderea completă din fizica microlumii a unor astfel de persoaneconcepte precum traiectoria unei particule și orbitele electronilor înatom. Un model planetar frumos și vizual al atomului, după cum sa dovedit,
Neajunsurile teoriei lui Bohr au indicat necesitatea revizuirii fundamentelor teoria cuanticași idei despre natura microparticulelor (electroni, protoni etc.). A apărut întrebarea cât de exhaustivă este reprezentarea unui electron sub forma unei particule mecanice mici, caracterizată de anumite coordonate și o anumită viteză.
Știm deja că în fenomenele optice se observă un fel de dualism. Alături de fenomenele de difracție, interferență (fenomene ondulatorii), se observă și fenomene care caracterizează natura corpusculară a luminii (efectul fotoelectric, efectul Compton).
În 1924, Louis de Broglie a emis ipoteza că dualismul nu este doar o caracteristică fenomene optice ,dar este universal. Particulele de materie au, de asemenea, proprietăți de undă .
„În optică”, a scris Louis de Broglie, „timp de un secol, metoda corpusculară a considerației a fost prea neglijată în comparație cu valul; S-a făcut eroarea inversă în teoria materiei? Presupunând că particulele de materie, împreună cu proprietățile corpusculare, au și proprietăți de undă, de Broglie a transferat în cazul particulelor de materie aceleași reguli pentru trecerea de la o imagine la alta, care sunt valabile în cazul luminii.
Dacă un foton are energie și impuls, atunci o particulă (de exemplu, un electron) care se mișcă cu o anumită viteză are proprietăți de undă, de exemplu. mișcarea particulelor poate fi considerată mișcare ondulatorie.
Conform mecanicii cuantice, mișcarea liberă a unei particule cu masă m iar impulsul (unde υ este viteza particulei) poate fi reprezentat ca o undă plană monocromatică ( val de Broglie) cu o lungime de undă
| (3.1.1) |
se propagă în aceeași direcție (de exemplu, în direcția axei X) în care particula se mișcă (Fig. 3.1).

Dependența funcției de undă de coordonată X este dat de formula
| , | (3.1.2) |
Unde - numărul de undă ,A vector val direcționat în direcția de propagare a undei sau de-a lungul mișcării particulei:
| . | (3.1.3) |
Prin urmare, vector de undă al unei unde monocromatice asociat cu o microparticulă care se mișcă liber, proporțional cu impulsul său sau invers proporțional cu lungimea de undă.
Deoarece energia cinetică a unei particule care se mișcă relativ lent, atunci lungimea de undă poate fi exprimată și în termeni de energie:
| . | (3.1.4) |
Când o particulă interacționează cu un obiect - cu un cristal, moleculă etc. – se modifică energia sa: i se adaugă energia potențială a acestei interacțiuni, ceea ce duce la o modificare a mișcării particulei. În consecință, natura propagării undei asociate cu particulele se schimbă, iar acest lucru are loc conform principiilor comune tuturor fenomenelor ondulatorii. Prin urmare, regularitățile geometrice de bază ale difracției particulelor nu diferă în niciun fel de regularitățile difracției oricăror unde. Condiția generală pentru difracția undelor de orice natură este comensurabilitatea lungimii de undă incidente λ cu distanta d între centrele de împrăștiere: .
Ipoteza lui Louis de Broglie a fost revoluționară, chiar și pentru acea perioadă revoluționară în știință. Cu toate acestea, a fost în curând confirmat de multe experimente.
Mecanica cuantică este o teorie modernă care stabilește metoda de descriere și legile mișcării microparticulelor (particule elementare, atomi, molecule, nuclee) și a sistemelor acestora. Neobișnuirea conceptelor mecanicii cuantice în comparație cu fizica clasică a deschis o perioadă de rupere a modelelor fizice de bază, care păreau evidente și indestructibile. Aceasta a vizat în principal conceptul de particule și principiile mișcării acesteia.
Acest capitol oferă un concept nu numai despre mecanica cuantică, ci și despre acele idei și experimente care au condus la această teorie. Microscopia electronică este considerată o metodă bazată pe proprietățile undei electronilor.
28.1. IPOTEZA LUI DE BROYLE. EXPERIMENTE PRIVIND DIFRACȚIA ELECTRONILOR ȘI A ALTOR PARTICLE
Un pas important în crearea mecanicii cuantice a fost descoperirea proprietăților de undă ale microparticulelor. Ideea proprietăților undelor a fost propusă inițial ca ipoteză de către fizicianul francez Louis de Broglie (1924) 1 .
În fizică de mulți ani a dominat teoria potrivit căreia lumina este o undă electromagnetică. Cu toate acestea, după lucrările lui Planck (radiația termică), Einstein (efectul fotoelectric) și alții, a devenit evident că lumina are proprietăți corpusculare.
1 Ipoteza lui De Broglie a fost formulată înaintea experimentelor care confirmă proprietățile undei ale particulelor. De Broglie a scris despre aceasta mai târziu, în 1936, după cum urmează: „... nu putem presupune că electronul este la fel de dual ca lumina? La prima vedere, această idee părea foarte îndrăzneață. La urma urmei, ne-am imaginat întotdeauna un electron ca fiind încărcat electric punct material, care respectă legile dinamicii clasice. Electronul nu a prezentat niciodată în mod explicit proprietăți de undă, cum ar fi, de exemplu, lumina în fenomenele de interferență și difracție. Încercarea de a atribui proprietăți de undă unui electron, atunci când nu există dovezi experimentale pentru acest lucru, ar putea arăta ca o fantezie neștiințifică.”
În cap. 24 s-a observat că pe corpuri cristaline se observă difracția cu raze X; prin urmare, substanțele cristaline trebuie folosite și pentru difracția electronilor.
K. Davisson și L. Germer au fost primii care au observat difracția electronilor pe un singur cristal de nichel, J.P. Thomson și, independent de el, P.S. Tartakovsky - pe o folie de metal (un corp policristalin).

Pe fig. 28.1 prezintă un electron gram - un model de difracție obținut din interacțiunea electronilor cu o folie policristalină.
Comparând această figură cu Fig. 24.21, se poate observa asemănarea difracției de electroni și de raze X.
Alte particule au, de asemenea, capacitatea de a difracta, atât încărcate (protoni, ioni etc.) cât și neutre (neutroni, atomi, molecule).
Similar cu analiza de difracție cu raze X, difracția particulelor poate fi utilizată pentru a determina aranjamentul ordonat sau dezordonat al atomilor și moleculelor unei substanțe și pentru a estima parametrii rețelelor cristaline.
În prezent, metodele de difracție a electronilor (difracția electronilor) și difracția neutronilor (difracția neutronilor) sunt utilizate pe scară largă.
Pot apărea întrebări: ce se întâmplă cu particulele individuale, cum se formează maximele și minimele în timpul difracției particulelor individuale?
Experimentele privind difracția fasciculelor de electroni de intensitate foarte mică, adică. ca și cum ar fi particule separate, a arătat că în acest caz electronul nu este „untat” în direcții diferite, ci se comportă ca o particulă întreagă. Cu toate acestea, probabilitatea deviației electronilor în direcții separate ca urmare a interacțiunii cu obiectul de difracție este diferită. Este cel mai probabil ca electronii să lovească locurile care, conform calculului, corespund maximelor de difracție, lovirea lor la minime este mai puțin probabilă. Astfel, proprietățile undelor sunt inerente nu numai colectivului de electroni, ci și fiecărui electron în mod individual.
28.2. MICROSCOP ELECTRONIC. CONCEPTUL DE OPTICĂ ELECTRONICĂ
Proprietățile de undă ale particulelor pot fi utilizate nu numai pentru analiza structurală prin difracție, ci și pentru obținerea de imagini mărite ale unui obiect.
Din (26.19) rezultă că limita de rezoluție a unui microscop optic este determinată în principal de valoarea limită a lungimii de undă a luminii percepute de ochiul uman. Înlocuind în această formulă valoarea lungimii de undă de Broglie (28.3), găsim limita de rezoluție a microscopului electronic, în care imaginea obiectului este formată din fascicule de electroni:
Este ușor de observat că limita de rezoluție z microscopul electronic depinde de tensiunea de accelerare și se poate realiza ca aceasta să fie mult mai mică, iar rezoluția să fie mult mai mare decât cea a unui microscop optic.
Un microscop electronic și elementele sale individuale sunt similare ca scop cu unul optic, așa că vom folosi o analogie pentru a explica structura și principiul său de funcționare. Diagramele ambelor microscoape sunt prezentate în fig. 28,2 (a - optic; b - electronic).
Într-un microscop optic, purtătorul de informații despre subiect AB este un foton, lumină. Sursa de lumină este de obicei o lampă cu incandescență /. După interacțiunea cu obiectul (absorbție, împrăștiere, difracție), fluxul de fotoni este transformat și conține informații despre obiect. Fluxul fotonic se formează folosind dispozitive optice, în principal lentile: condensator 3, obiectiv 4, ocular 5. Imaginea A 1 B 1 este înregistrată de ochiul 7 (sau o placă fotografică, ecran fotoluminiscent etc.).
Într-un microscop electronic, purtătorul de informații despre un obiect este un electron, iar sursa de electroni este un catod încălzit 1. Accelerația electronilor și formarea unui fascicul este efectuată de un electrod de focalizare și un anod - un sistem numit tun de electroni 2. După interacțiunea cu obiectul (în principal împrăștiere), fluxul de electroni este convertit și conține informații despre subiect. Formarea unui flux de electroni are loc sub influența câmp electric(sistem de electrozi și condensatori) și magnetice (sistem-

ma bobine cu curent). Aceste sisteme sunt numite lentile electronice prin analogie cu lentilele optice care formează un flux de lumină. (3 - condensator; 4 - electronic, care servește drept obiectiv, 5 - proiecție). Imaginea este înregistrată pe o placă fotografică sensibilă la electroni sau pe un ecran catodoluminiscent 6.
Pentru a estima limita de rezoluție a unui microscop electronic, să substituim în formula (28.4) o tensiune de accelerație de 100 kV și o deschidere unghiulară de ordinul a 10 -2 rad (aproximativ astfel de unghiuri sunt utilizate în microscopia electronică). Apoi primim z ~ 0,1 nm, ceea ce este de sute de ori mai bun decât microscoapele optice. Utilizarea unei tensiuni de accelerare mai mare de 100 kV, deși crește rezoluția, este asociată cu unele dificultăți, în special, apare
distrugerea obiectului studiat de către electroni cu viteză mare. În practică, chiar și cu cel mai bun microscop electronic, se poate atinge o limită de rezoluție de ordinul a 10 -10 m; aceasta este de sute de ori mai bună decât microscoapele optice.
Avantajele unui microscop electronic includ o rezoluție mare care permite luarea în considerare a moleculelor mari, capacitatea de a modifica, dacă este necesar, tensiunea de accelerare și, în consecință, limita de rezoluție și controlul relativ convenabil al fluxului de electroni folosind câmpuri magnetice și electrice. .
Să indicăm câteva caracteristici ale funcționării unui microscop electronic. În acele părți ale acestuia în care zboară electronii, trebuie să existe un vid, deoarece, altfel, ciocnirea electronilor cu moleculele de aer (gaz) va duce la distorsiunea imaginii. Această cerință pentru microscopia electronică complică procedura de examinare, face echipamentul mai greoi și mai costisitor. Vidul distorsionează proprietățile native ale obiectelor biologice și, în unele cazuri, le distruge sau le deformează.
Doar secțiunile foarte subțiri sunt potrivite pentru vizualizare într-un microscop electronic, deoarece electronii sunt puternic absorbiți și împrăștiați de substanță. Prin urmare, în unele cazuri este recomandabil să se facă o amprentă a suprafeței investigate a obiectului pe un strat subțire de plastic. Această procedură se numește replicare, iar o copie din plastic a suprafeței este replica.

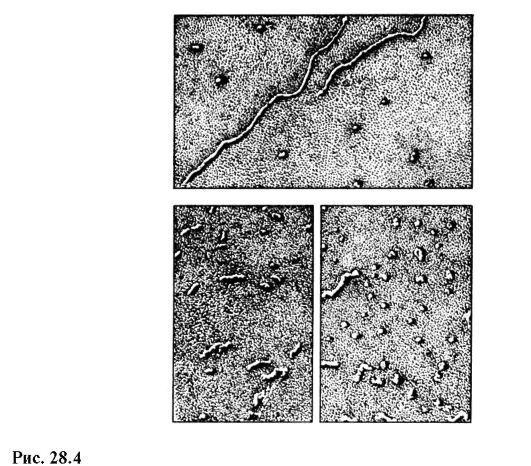
Microscopul electronic modern de uz casnic EVM-100 LM (Fig. 28.3) oferă o mărire maximă de 600.000 de ori și o limită de rezoluție garantată de 3? 10 -10 m. În fig. 28.4 prezintă imagini ale moleculelor de ARN în diferite stări, obținute la un microscop electronic cu o mărire de 100.000 de ori.
Prezența proprietăților ondulatorii și corpusculare atât ale fotonilor, cât și ale electronilor și ale altor particule permite extinderea unui număr de prevederi și legi ale opticii pentru a descrie mișcarea particulelor încărcate în câmpurile electrice și magnetice.
Această analogie a făcut posibilă identificarea ca o secțiune independentă optică electronică - un domeniu al fizicii în care se studiază structura fasciculelor de particule încărcate care interacționează cu câmpurile electrice și magnetice. Ca și optica convențională, electronica poate fi împărțită în geometric (grindă) și val(fizic).
În cadrul opticii electronice geometrice, în special, este descrisă mișcarea particulelor încărcate în câmpurile electrice și magnetice. Reprezentarea schematică a imaginilor într-un microscop electronic (vezi Fig. 28.2, b) se bazează pe optica electronică geometrică.
Abordarea opticii electronilor unde este esențială în cazul în care se manifestă proprietățile de undă ale particulelor încărcate. O ilustrare bună este găsirea rezoluției (limita de rezoluție) dată la începutul paragrafului.
28.3. FUNCȚIA UNDEI ȘI SENSUL EI FIZIC
Deoarece o microparticulă este asociată cu un proces ondulatoriu care corespunde mișcării sale, starea particulelor în mecanica cuantică este descrisă de o funcție de undă care depinde de coordonate și timp: ψ(χ, y, z, t).
Dacă câmpul de forță care acționează asupra particulei este staționar, i.e. independent de timp, atunci funcția ψ poate fi reprezentată ca un produs al doi factori, dintre care unul depinde de timp, iar celălalt de coordonate:
În cele ce urmează, vom lua în considerare numai stările staționare; Funcția ψ este o caracteristică probabilistică a stării unei particule. Să explicăm sensul acestei afirmații.
Să alocăm un volum suficient de mic în spațiu dV= dxdjdz, în cadrul căruia valorile funcției ψ pot fi considerate aceleași. Probabilitatea de a găsi dW B particulele din acest volum este proporțională cu volumul și depinde de pătratul modulului funcției ψ:

Pătratul modulului funcției de undă este egal cu densitatea de probabilitate, adică. raportul dintre probabilitatea de a găsi o particulă într-un volum și acest volum.
Integrând expresia (28.6) pe un volum V, găsim probabilitatea de a găsi o particulă în acest volum:
28.4. RELAȚII DE INCERTITUDINE
Una dintre prevederile importante ale mecanicii cuantice sunt relaţiile de incertitudine propuse de W. Heisenberg.
Fie măsurate simultan poziția și impulsul particulei, în timp ce inexactitățile în definițiile abscisei și proiecția impulsului pe axa absciselor sunt Δχ și, respectiv, Δр x.

1 Într-adevăr, este imposibil să se efectueze un astfel de experiment, deoarece dimensiunile golului trebuie să fie de ordinul atomilor, prin urmare, este descris un experiment mental.

Soluția (28.11) înseamnă că cu cât timpul de existență al oricărei stări a sistemului este mai scurt, cu atât valoarea sa de energie este mai incertă. Nivelurile de energie E 1 , E 2 etc. au o anumită lățime (Fig. 28.6), în funcție de timpul în care sistemul se află în starea corespunzătoare acestui nivel.
„Neclaritatea” nivelurilor duce la incertitudinea energiei AE a fotonului emis și a frecvenței acestuia Ay în timpul tranziției sistemului de la un nivel de energie la altul:
Deoarece starea unei microparticule este descrisă de funcția ψ, este necesar să se indice metoda de găsire a acestei funcții, ținând cont de condițiile externe. Acest lucru este posibil ca urmare a rezolvării ecuației de bază a mecanicii cuantice propusă de E. Schrödinger (1926). O astfel de ecuație este postulată în mecanica cuantică în același mod în care a doua lege a lui Newton este postulată în mecanica clasică.
După cum se aplică stărilor staționare, ecuația Schrödinger poate fi scrisă după cum urmează:
Aceasta se manifestă prin lărgirea liniilor spectrale.
28.5. ECUAȚIA SCHROEDINGER. ELECTRONUL ÎNTR-UN POTENȚIAL FUNȚ
Unde m- masa particulelor; Eși E p sunt energiile sale totale și potențiale (energia potențială este determinată de câmpul de forță în care se află particula, iar pentru cazul staționar nu depinde de timp).
Dacă particula se mișcă numai de-a lungul unei linii, de exemplu de-a lungul axei X(caz unidimensional), atunci ecuația Schrödinger este simplificată semnificativ și ia forma:
Unul dintre cele mai simple exemple de utilizare a ecuației Schrödinger este soluția problemei mișcării unei particule într-un puț de potențial unidimensional.
Lasă electronul să se miște de-a lungul axei X doar in limita 0< X < l(Fig. 28.7). Aceasta înseamnă că în intervalul indicat funcția ψ este diferită de zero și în afara intervalului (x<0, X>l) este egal cu zero.
Deoarece câmpurile de forță nu acționează asupra particulei în intervalul selectat, energia sa potențială poate avea orice valoare constantă (cel mai convenabil este să se ia E p= 0). În afara acestui interval, nu există niciun electron, așa că energia sa potențială ar trebui considerată infinit de mare. Pe fig. 28.7 arată o dependență grafică a lui E p \u003d D x). Intervalul 0< X < l, удовлетворяющий сформулированным выше условиям, называют одномерной прямоугольной gaura potentiala cu pereți infinit de înalți. Având în vedere E p= 0 Ecuația Schrödinger (28.14) pentru intervalul 0< X < l se pare ca:

Această ecuație este similară ecuație diferențială oscilație armonică (vezi 7.1) a cărei soluție este:

În primul rând, este de remarcat faptul că soluția ecuației Schrödinger pentru un electron într-un puț de potențial fără postulate suplimentare duce la valori de energie discrete, cuantificate:

Din (28.21) se poate observa că pentru o valoare fixă n discretie, adica diferența dintre energiile nivelurilor învecinate este cu cât este mai mică, cu atât dimensiunea puțului de potențial este mai mare. De exemplu, luați în considerare două cazuri n = 1:
1) l= 5? 10 -10 m, care corespunde aproximativ mărimii unui atom; apoi ΔΕ = 4,5 eV. Aceasta coincide în ordinea mărimii cu valorile obținute pentru atomul de hidrogen conform teoriei lui Bohr;
2) l= 10 -1 m, care corespunde de fapt unei astfel de lățimi a puțului de potențial încât electronul poate fi considerat liber; în care ΔΕ = 1.1? 10 -16 eV. Aici, discretitatea este neglijabilă și practic se poate considera că energia electronilor se modifică continuu.
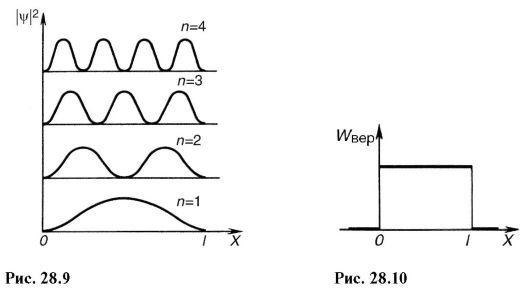
La pătrat (28.20), obținem densitatea de probabilitate |ψ| 2 găsirea unui electron în diferite puncte ale puțului de potențial. Pe fig. 28.9 arată dependența grafică |ψ| 2 off χ la diferite stări discrete, de ex. numere cuantice diferite. După cum se poate observa din figură, un electron poate fi în diferite locuri ale puțului de potențial cu probabilități diferite. Există puncte în care probabilitatea de a găsi un electron este în general egală cu zero. Aceasta diferă semnificativ de ideile fizicii clasice, conform cărora este la fel de probabil ca o particulă să fie situată în locuri diferite ale puțului de potențial (Fig. 28.10) și este imposibil să se împartă puțul în puncte în care prezența unei particulele sunt excluse.
Ecuația Schrödinger poate fi aplicată și la câmpuri de forțe mai complexe, cum ar fi un electron dintr-un atom. Acest lucru va duce la dificultăți matematice suplimentare, dar nu va schimba caracteristicile principale.
sisteme atomice: discretitatea stărilor energetice, judecăți probabilistice despre găsirea unui electron, un fel de dependență |ψ| 2 din coordonate etc.
28.6. APLICAREA ECUAȚIEI SCHROEDINGER LA ATOMUL DE HIDROGEN. NUMERE CUANTICE
Descrierea stărilor atomilor și moleculelor folosind ecuația Schrödinger este o sarcină destul de dificilă. Este cel mai simplu rezolvat pentru un electron situat în câmpul nucleului. Astfel de sisteme corespund atomului de hidrogen și ionilor de tip hidrogen (atomul de heliu ionizat unic, atomul de litiu dublu ionizat etc.). Totuși, și în acest caz, soluția problemei depășește domeniul de aplicare al cursului nostru, așa că ne limităm la o prezentare calitativă a problemei.
În primul rând, energia potențială ar trebui înlocuită în ecuația Schrödinger (28.13), care pentru două sarcini punctiforme care interacționează - e(electron) și Ze(miez), - situat la distanță rîn vid, se exprimă după cum urmează:
Cu simetria centrală a câmpului creat de nucleu, este mai convenabil să rezolvi problema nu în coordonate dreptunghiulare carteziene, ci în sferice r, θ și p.
Soluția ecuației Schrödinger se găsește ca produs a trei funcții, fiecare dintre ele depinde de o variabilă:
La fel ca pentru un electron într-un puț de potențial dreptunghiular cu pereți infinit de înalți condiţiile de frontieră a condus la posibile valori specifice ale ψ și energiei, iar în puțul de potențial corespunzător atomului de hidrogen, condițiile fizice duc la posibile valori ale f1, f2, f3și deci funcții ψ. Aici se manifestă și principala trăsătură a sistemelor mecanic-cuantice - discretitatea stărilor.
Discretența constă din punct de vedere matematic în faptul că oricare dintre funcțiile ecuației (28.23) are un întreg (spectru) de soluții, fiecare dintre ele corespunde unui anumit număr cuantic. Spre deosebire de un puț de potențial dreptunghiular cu pereți infinit de înalți, starea unui electron într-un atom este caracterizată nu de unul, ci de mai multe numere cuantice 1 . Primul dintre ei - număr cuantic principal P - 1, 2, 3... Determină nivelurile de energie ale unui electron conform legii:

Această expresie este o soluție a ecuației Schrödinger și coincide complet cu formula corespunzătoare a teoriei lui Bohr (vezi 28.7).
Pe fig. 28.11 arată nivelurile valorilor posibile ale energiei totale a atomului de hidrogen (E 1, E 2, E 3 etc.) și graficul de dependență energie potențială E P de la distanță rîntre un electron și un nucleu [vezi (28.22)]. Pe măsură ce numărul cuantic principal crește P crește r[vezi, de exemplu, (28.33)], iar completa [vezi. (28.24)] iar energia potențială tinde spre zero. Energie kinetică tinde de asemenea spre zero. Zona umbrită (E > 0) corespunde stării unui electron liber.
1 În cazul general, numerele cuantice sunt numere întregi (0, 1, 2...) sau semiîntregi (1/2, 3/2, 5/2...) care definesc posibile valori discrete mărimi fizice, care caracterizează sistemele cuantice și particulele elementare.

1 Prezența spinului în particule nu rezultă din ecuația Schrödinger.
cu acest calcul: mai mult timp a fost în locuri cu o densitate de probabilitate mai mare, mai puțin lung - în locuri cu o densitate de probabilitate mai mică. În urma expunerii pe film s-au obținut locuri de intensitate diferită, care ilustrează distribuția unui electron într-un atom. Se poate observa din figuri cât de condiționat și chiar incorect este conceptul de „orbită” în raport cu mișcarea unui electron.
Spinul și momentele magnetice orbitale interacționează între ele, acest lucru schimbă sistemul de niveluri de energie ale atomului în comparație cu cel care ar fi fără o astfel de interacțiune. Se spune că interacțiunea spin-orbita duce la structură fină niveluri de energie. Dacă este semnificativ, atunci este necesar să se ia în considerare momentul unghiular total al electronului - orbital plus spin. Între timp, în loc de m lși Domnișoară utilizați alte numere cuantice: jși nij.
numărul cuantic j- orbital plus spin - determină valorile discrete ale momentului unghiular total L electron:

Număr cuantic magnetic m) caracterizează proiecțiile posibile ale momentului unghiular total pe o direcție aleasă în mod arbitrar Z:
Pentru un dat l număr cuantic j ia două valori: ±1/2
(Tabelul 28.1).
Tabelul 28.1

Pentru un dat j număr cuantic nij ia 2j + 1 valori: -j, -j + 1 ... + j.
28.7. CONCEPTUL DE TEORIA BORULUI
Chiar înainte de crearea mecanicii cuantice în 1913, fizicianul danez N. Bohr a propus o teorie a atomului de hidrogen și a ionilor de tip hidrogen, care se baza pe modelul nuclear al atomului și pe cele două postulate ale acestuia. Postulatele lui Bohr nu se încadrau în cadrul fizicii clasice.
Conform primului postulat, un atom și sistemele atomice pot rămâne mult timp doar în anumite stări staționare. Fiind în astfel de stări, atomul nu emite sau absoarbe energie. Stările staționare corespund unor valori discrete de energie: E 1, E 2...
Orice modificare a energiei unui atom sau a unui sistem atomic este asociată cu o tranziție bruscă de la o stare staționară la alta.
Conform celui de-al doilea postulat, în timpul tranziției unui atom de la o stare la alta, atomul emite sau absoarbe un foton, a cărui energie este determinată de ecuația (29.1).
Trecerea de la o stare cu o energie mai mare la o stare cu o energie mai mică este însoțită de emisia unui foton. Procesul invers este posibil atunci când un foton este absorbit.
Conform teoriei lui Bohr, un electron dintr-un atom de hidrogen se rotește pe o orbită circulară în jurul nucleului. Dintre toate orbitele posibile, stările staționare corespund doar celor pentru care momentul unghiular este un întreg h/(2π):
(n = 1, 2, 3...), (28,31)
Unde m- masa electronilor; υ η - viteza sa activată a n-a orbită; rn este raza sa. Un electron care se rotește pe o orbită circulară într-un atom este afectat de forța de atracție Coulomb din partea unui nucleu încărcat pozitiv, care, conform celei de-a doua legi a lui Newton, este egală cu produsul masei electronului cu accelerație centripetă(record dat pentru vid):

În ciuda marelui succes al teoriei lui Bohr, neajunsurile acesteia au devenit curând evidente. Astfel, în cadrul acestei teorii, nu a fost posibil să se explice diferența de intensități ale liniilor spectrale, i.e. răspunde la întrebarea de ce unele tranziții energetice sunt mai probabile decât altele. Teoria lui Bohr nu a dezvăluit modelele spectrale ale unui sistem atomic mai complex - atomul de heliu (doi electroni care se rotesc în jurul nucleului).
Dezavantajul teoriei lui Bohr a fost inconsecvența acesteia. Această teorie nu era nici clasică, nici cuantică, ea combina prevederile unor teorii fundamental diferite: fizica clasică și cuantică. Deci, de exemplu, în teoria lui Bohr, se crede că un electron se rotește într-un atom pe o anumită orbită (reprezentări clasice), dar nu emite o undă electromagnetică (reprezentări cuantice).
În primul sfert al secolului nostru a devenit clar că teoria lui Bohr trebuie înlocuită cu o altă teorie a atomului. A apărut mecanica cuantică.
28.8. COCHILE ELECTRONICE ALE ATOMILOR COMPLEXI
Numerele cuantice care descriu starea unui electron într-un atom de hidrogen sunt folosite pentru a aproxima starea electronilor individuali din atomi complecși. Cu toate acestea, ar trebui să se țină cont de cel puțin două diferențe semnificative între atomii complecși și atomul de hidrogen:
1) la atomii complecși, energia electronilor, datorită interacțiunii lor, depinde nu numai de n, ci și de /;
2) diferența se datorează principiului Pauli, conform căruia un atom nu poate avea doi (sau mai mulți) electroni cu patru numere cuantice identice.
În formarea unei configurații electronice corespunzătoare stării normale, fiecare electron al atomului tinde să aibă cea mai mică energie. Dacă nu ar fi principiul Pauli, atunci toți electronii ar fi localizați la cel mai scăzut nivel de energie. De fapt, cu unele excepții, electronii ocupă secvența de stări care este indicată pentru atomul de hidrogen în tabel. 29.
Electronii cu același număr cuantic principal formează un strat. Straturile sunt numite LA, L M, N etc. in conformitate cu n= 1, 2, 3, 4... Electroni având aceleași perechi valori nși / , fac parte din înveliș, care este notat pe scurt în același mod ca și stările corespunzătoare pentru electronul atomului de hidrogen: 1s, 2s, 2^ etc. Deci, de exemplu, se numesc învelișul 2s, electronii 2s etc.
Numărul de electroni din înveliș este indicat în dreapta sus, lângă notația simbolică a învelișului, de exemplu 2p 4 .
Distribuția electronilor peste învelișurile unui atom (configurații electronice) este de obicei indicată după cum urmează: pentru azot 1s 2, 2s2, 2p 3, pentru calciu 1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2 etc.
Deoarece energia electronilor atomilor complecși depinde nu numai de n, ci și de eu atunci construcția tabelului periodic nu are loc întotdeauna prin umplerea treptată a straturilor pe măsură ce atomul devine mai complex. Pentru potasiu (Z = 19), de exemplu, în loc să umpleți stratul M(ar fi putut fi 1s 2 , 2s 2 , 2^ 6 , 3s 2 , 3r 6, 3a 1) începe umplerea stratului Nși se creează următoarea configurație electronică: 1 s2, 2s 2, 2p 6, 3s 2, 3r 6, 4s 1.
Alte elemente au, de asemenea, abateri similare de la umplerea obișnuită a straturilor.
Regula generală este întotdeauna îndeplinită: electronii unui atom neexcitat ocupă starea cu cea mai mică energie și în conformitate cu principiul Pauli. Pe fig. 28.13 schematic, fără a respecta scara, sunt prezentate stările energetice ale unui atom complex și numărul corespunzător de electroni.
În concluzie, observăm că starea unui atom multielectron în ansamblu este determinată de următoarele numere cuantice: L- impulsul orbital total al atomului, care ia valorile 0, 1, 2, 3 etc. unu ; J- momentul total al atomului, care poate lua valori cu un interval de unu din |L - S| la |L + S |; S- momentul de spin rezultat al atomului; magnetic m J, care determină valorile discrete ale proiecției impulsului total al atomului pe o anumită axă Z:

Pentru un dat Jm J ia 2 J+ 1 valori:
-J, -J+ 1 ... +J.
1 Nu confundați această denumire cu numele stratului electronic L iar cu momentul unghiular total al electronului.
28.9. NIVELURI DE ENERGIE ALE MOLECULELOR
Deoarece moleculele sunt formate din atomi, mișcarea intramoleculară este mai complicată decât mișcarea intraatomică. Într-o moleculă, pe lângă mișcarea electronilor în raport cu nucleele, mișcare oscilantă atomii în jurul poziției lor de echilibru (vibrația nucleelor împreună cu electronii din jurul lor) și mișcarea de rotație a moleculei în ansamblu.
Electronice, oscilatorii și mișcări de rotație moleculele corespund la trei tipuri de niveluri de energie: E el, E count și E timp. Conform mecanicii cuantice, energia tuturor tipurilor de mișcare dintr-o moleculă ia doar valori discrete (cuantizate). Să reprezentăm aproximativ energia totală E a moleculei ca sumă a valorilor cuantificate ale energiilor de diferite tipuri:
E\u003d E el + E număr + E timp. (28,37)
Pe fig. 28.14 descrie schematic sistemul de niveluri al unei molecule: niveluri de energie electronică distanțate. A"și A"", pentru care E count = E vr = 0; niveluri vibraționale mai apropiate v" , v"", pentru ele E r = 0; cele mai apropiate niveluri de rotație J"și J"" cu diferite valori ale timpului E.
Distanța dintre nivelurile de energie electronică este de ordinul mai multor electron volți, între nivelurile de vibrație adiacente 10 -2 -10 -1 eV, între nivelurile de rotație adiacente 10 -5 -10 -3 eV.

Desigur, poți numi asta o prostie,
dar am întâlnit asemenea prostii încât în
în comparație cu ea, acesta pare sensibil
dicţionar.
L. Carroll
Care este modelul planetar al atomului și care este dezavantajul acestuia? Care este esența modelului Bohr al atomului? Care este ipoteza despre proprietățile undei ale particulelor? Ce predicții oferă această ipoteză despre proprietățile microlumii?
Lecție-prelecție
MODELE CLASICE ALE ATOMULUI SI DEZAVANTAJELE LOR. Ideile conform cărora atomii nu sunt particule indivizibile și conțin sarcini elementare ca particule constitutive au fost exprimate pentru prima dată la sfârșitul secolului al XIX-lea. Termenul de „electron” a fost propus în 1881 de către fizicianul englez George Stoney. În 1897, ipoteza electronică a primit confirmare experimentală în studiile lui Emil Wiechert și Joseph John Thomson. Din acel moment, a început crearea diferitelor modele electronice de atomi și molecule.
Primul model al lui Thomson presupunea că sarcina pozitivă era distribuită uniform în întregul atom, iar electronii erau intercalate în el, ca stafidele într-o chiflă.
Discrepanța dintre acest model și datele experimentale a devenit clară după un experiment din 1906 al lui Ernest Rutherford, care a studiat procesul de împrăștiere a particulelor α de către atomi. Din experiență s-a ajuns la concluzia că sarcina pozitivă este concentrată în interiorul formațiunii, mult mai mică decât dimensiunea atomului. Această formație se numește nucleul atomic, ale căror dimensiuni au fost 10 -12 cm, iar dimensiunile atomului - 10 -8 cm.În conformitate cu ideile clasice ale electromagnetismului, forța de atracție Coulomb trebuie să acționeze între fiecare electron și nucleu. Dependența acestei forțe de distanță ar trebui să fie aceeași ca și în legea gravitației universale. Prin urmare, mișcarea electronilor într-un atom trebuie să fie similară cu mișcarea planetelor sistemului solar. Așa s-a născut modelul planetar al atomului Rutherford.
Durata scurtă de viață a unui atom și spectrul continuu de radiații, care decurg din modelul planetar, și-au arătat inconsecvența în descrierea mișcării electronilor într-un atom.
Un studiu suplimentar al stabilității atomului a dat un rezultat uimitor: calculele au arătat că într-un timp de 10 -9 s, electronul trebuie să cadă pe nucleu din cauza pierderii de energie pentru radiație. În plus, un astfel de model a oferit mai degrabă spectre de emisie continue decât discrete ale atomilor.
TEORIA ATOMILOR DE BUR. Următorul pas important în dezvoltarea teoriei atomilor a fost făcut de Niels Bohr. Cea mai importantă ipoteză prezentată de Bohr în 1913 a fost ipoteza structurii discrete a nivelurilor de energie ale unui electron dintr-un atom. Această poziție este ilustrată în diagramele energetice (Fig. 21). În mod tradițional, diagramele de energie grafică energia de-a lungul axei verticale.
Orez. 21 Energia satelitului în câmpul gravitațional al Pământului (а); energia unui electron într-un atom (b)
Diferența dintre mișcarea unui corp într-un câmp gravitațional (Fig. 21, a) și mișcarea unui electron într-un atom (Fig. 21, b) în conformitate cu ipoteza Bohr este că energia corpului poate continuu schimbare, iar energia unui electron cu valori negative poate lua seria de valori discrete prezentate în figură ca segmente albastre. Aceste valori discrete au fost numite niveluri de energie sau, cu alte cuvinte, niveluri de energie.
Desigur, ideea nivelurilor de energie discrete a fost preluată din ipoteza lui Planck. Modificarea energiei unui electron, în conformitate cu teoria lui Bohr, ar putea avea loc doar într-un salt (de la un nivel de energie la altul). În timpul acestor tranziții, un cuantum de lumină este emis (tranziție în jos) sau absorbit (tranziție ascendentă), a cărui frecvență este determinată din formula Planck hv \u003d E quantum \u003d ΔE a atomului, adică schimbarea energiei lui atomul este proporțional cu frecvența cuantumului de lumină emis sau absorbit.
Teoria lui Bohr a explicat perfect caracterul de linie al spectrelor atomice. Cu toate acestea, teoria de fapt nu a dat un răspuns la întrebarea despre motivul discretității nivelurilor.
UNDE DE SUBSTANȚĂ. Următorul pas în dezvoltarea teoriei microlumilor a fost făcut de Louis de Broglie. În 1924, el a sugerat că mișcarea microparticulelor ar trebui descrisă nu ca fiind clasică mișcare mecanică, dar ca un fel de mișcare ondulatorie. Din legile mișcării ondulatorii trebuie obținute rețete pentru calcularea diferitelor mărimi observabile. Deci, în știință, împreună cu undele câmpului electromagnetic, au apărut și undele de materie.
Ipoteza despre natura ondulatorie a mișcării particulelor a fost la fel de îndrăzneață ca și ipoteza lui Planck despre proprietățile discrete ale câmpului. Un experiment care confirmă direct ipoteza lui de Broglie a fost pus la cale abia în 1927. În acest experiment a fost observată difracția electronilor pe un cristal, similară cu difracția unei unde electromagnetice.
Teoria lui Bohr a fost un pas important în înțelegerea legilor microlumii. A fost primul care a introdus prevederea privind valorile discrete ale energiei unui electron într-un atom, care corespundea experienței și, ulterior, a devenit parte a teoriei cuantice.
Ipoteza undelor de materie a făcut posibilă explicarea naturii discrete a nivelurilor de energie. Din teoria undelor se știa că o undă limitată în spațiu are întotdeauna frecvențe discrete. Un exemplu este valul într-un instrument muzical precum flaut. Frecvența sunetului în acest caz este determinată de dimensiunile spațiului la care este limitată unda (dimensiunile flautului). Se pare că aceasta este o proprietate generală a undelor.
Dar, în conformitate cu ipoteza lui Planck, frecvențele cuantumului unei unde electromagnetice sunt proporționale cu energia cuantei. În consecință, energia electronului trebuie să ia și valori discrete.
Ideea lui de Broglie s-a dovedit a fi foarte fructuoasă, deși, așa cum am menționat deja, un experiment direct care confirmă proprietățile undei ale unui electron a fost efectuat abia în 1927. atomul de hidrogen, a obținut toate rezultatele pe care teoria lui Bohr a fost capabilă de dând. De fapt, acesta a fost începutul unei teorii moderne care descrie procesele din microlume, deoarece ecuația de undă a fost ușor generalizată pentru o varietate de sisteme - atomi cu mulți electroni, molecule, cristale.
Dezvoltarea teoriei a condus la înțelegerea faptului că unda corespunzătoare particulei determină probabilitatea de a găsi particulei într-un punct dat din spațiu. Deci conceptul de probabilitate a intrat în fizica microcosmosului
Conform noii teorii, unda corespunzătoare particulei determină complet mișcarea particulei. Dar proprietățile generale ale undelor sunt de așa natură încât o undă nu poate fi localizată în niciun punct din spațiu, adică este lipsit de sens să vorbim despre coordonatele unei particule la un moment dat în timp. Consecința acestui lucru a fost excluderea completă din fizica microcosmosului a unor concepte precum traiectoria unei particule și orbitele electronilor într-un atom. Un model planetar frumos și vizual al atomului, după cum sa dovedit, nu corespunde mișcării reale a electronilor.
Toate procesele din microcosmos au un caracter probabilist. Numai probabilitatea ca un anumit proces să se producă poate fi determinată prin calcule.
În concluzie, să revenim la epigraf. Ipotezele despre undele de materie și cuantele câmpului li s-au părut o prostie pentru mulți fizicieni care au fost crescuți în tradițiile fizicii clasice. Cert este că aceste ipoteze sunt lipsite de vizualizarea obișnuită pe care o avem atunci când facem observații în macrocosmos. Cu toate acestea, dezvoltarea ulterioară a științei microlumilor a condus la astfel de idei care ... (vezi epigraful paragrafului).
- Ce fapte experimentale a contrazis modelul lui Thomson al atomului?
- Ce rămâne din modelul atomic al lui Bohr în teoria modernă și ce a fost aruncat?
- Ce idei au contribuit la ipoteza lui de Broglie despre undele materiei?