Dualnost talas-čestica- svojstvo bilo koje mikročestice da detektuje znakove čestice (korpuskule) i talasa. Korpuskularno-talasni dualizam se najjasnije manifestuje u elementarnim česticama. Elektron, neutron, foton se pod nekim uslovima ponašaju kao materijalni objekti (čestice) dobro lokalizovani u prostoru, krećući se određenim energijama i momentima po klasičnim putanjama, au drugim uslovima ponašaju se kao talasi, što se manifestuje u njihovoj sposobnosti interferencije i difrakcije. . Dakle, elektromagnetski val, koji se raspršuje na slobodnim elektronima, ponaša se kao tok pojedinačnih čestica - fotona, koji su kvanti elektromagnetskog polja (Comtonov efekat), a zamah fotona je dan formulom p \u003d h / λ , gdje je λ dužina elektromagnetnog talasa, a h Plankova konstanta. Ova formula sama po sebi je dokaz dualizma. U njemu lijevo je impuls pojedine čestice (foton), a desno talasna dužina fotona. Dualizam elektrona, koje smo navikli smatrati česticama, očituje se u činjenici da se pri reflektiranju od površine jednog kristala uočava difrakcijski uzorak, koji je manifestacija valnih svojstava elektrona. Kvantitativni odnos između korpuskularnih i talasnih karakteristika elektrona je isti kao i za foton: r = h/λ (r je impuls elektrona, a λ njegova de Broljeva talasna dužina). U osnovi je dualnost talas-čestica kvantna fizika.
Talas (krzno) je proces koji je uvijek povezan s materijalnim medijem koji zauzima određeni volumen u prostoru.
64. Waves de Broglie. Difrakcija elektrona Talasna svojstva mikročestica.
Razvoj ideja o korpuskularno-valnim svojstvima materije dobijen je u hipotezi o talasnoj prirodi kretanja mikročestica. Louis de Broglie, iz ideje simetrije u prirodi za čestice materije i svjetlosti, pripisuje bilo kojoj mikročestici neki unutrašnji periodični proces (1924). Kombinirajući formule E = hν i E = mc 2 , dobio je relaciju koja pokazuje da svaka čestica ima svoju talasna dužina : λ B \u003d h / mv \u003d h / p, gdje je p impuls čestice vala. Na primjer, za elektron koji ima energiju od 10 eV, de Broglieova talasna dužina je 0,388 nm. Kasnije je pokazano da se stanje mikročestice u kvantnoj mehanici može opisati određenim kompleksom valna funkcija koordinate Ψ(q), i kvadrat modula ove funkcije |Ψ| 2 definira distribuciju vjerovatnoće koordinatnih vrijednosti. Ovu funkciju je prvi put u kvantnu mehaniku uveo Schrodinger 1926. Dakle, de Broglieov talas ne nosi energiju, već samo odražava “distribuciju faza” nekog vjerovatnog periodičnog procesa u prostoru. Stoga je opis stanja objekata mikrosvijeta vjerovatnosti karakter, za razliku od objekata makrokosmosa, koji su opisani zakonima klasične mehanike.
Kako bi dokazao de Broglieovu ideju o talasnoj prirodi mikročestica, njemački fizičar Elsaser je predložio korištenje kristala za promatranje difrakcije elektrona (1925). U SAD su K. Davisson i L. Germer otkrili fenomen difrakcije tokom prolaska snopa elektrona kroz ploču od kristala nikla (1927). Nezavisno od njih, difrakciju elektrona pri prolasku kroz metalnu foliju otkrili su J.P. Thomson u Engleskoj i P.S. Tartakovski u SSSR-u. Tako je ideja de Brogliea o valnim svojstvima materije našla eksperimentalnu potvrdu. Nakon toga, otkrivena su difrakciona, a time i valna svojstva u atomskim i molekularnim zrakama. Svojstva korpuskularnog talasa poseduju ne samo fotoni i elektroni, već i sve mikročestice.
Otkriće valnih svojstava mikročestica pokazalo je da takvi oblici materije kao što su polje (kontinuirano) i materija (diskretna), koji se, sa stanovišta klasične fizike, smatraju kvalitativno različitim, pod određenim uslovima mogu pokazati svojstva svojstvena oba forme. Ovo govori o jedinstvu ovih oblika materije. Potpuni opis njihovih svojstava moguć je samo na osnovu suprotnih, ali komplementarnih ideja.
KLASIČNI MODELI ATOMA I NJIHOVI DEFEKTI.
Ideje o čemu atomi nisu nedjeljive čestice i sadrže kao sastavne dijelove
čestice elementarnih naboja, prvo su navedene na kraju19. vek Termin "elektron" predložio je 1881. engleski fizičar DžordžStoney. Godine 1897, elektronska hipoteza je dobila eksperimentalnupotvrda u studijama Emila Wiecherta i Josepha Jana Thomsona. Od tog trenutka počinje stvaranje raznih elektronskih modela.atoma i molekula.Prvi Thomsonov model pretpostavljao je da je pozitivno naelektrisanje uniformnoraspršen po atomu, iu njemu, kao grožđice u lepinji,ugrađeni elektroni.Nedosljednost ovog modela s eksperimentalnim podacima postala je jasnanakon eksperimenta 1906. od strane Ernesta Rutherforda, koji je istraživao
proces raspršivanja a-čestica atomima. Iz iskustva ste stvoreni,da je pozitivan naboj koncentrisan unutar formacije, bitno jemanji od veličine atoma. Ova formacija je nazvana atomskajezgra, čije su dimenzije bile 1 o-12 cm, a dimenzije atoma 1 o-in cm.
U skladu sa klasičnim konceptima elektromagnetizmaizmeđu svakog elektrona i jezgra mora djelovati Kulonova silaatrakcija. Zavisnost ove sile od udaljenosti treba bitiisto kao u zakonu gravitacija. Dakle, pokret
elektroni u atomu bi trebali biti sličniveć kretanje planeta Solarni sistem. Tako je rođen planetarni modelRutherfordov atom.Dalje istraživanje održivostiatom je dao zapanjujući rezultat:proračuni su pokazali da je tokom1 o-9 s elektron mora pasti na jezgro
zbog gubitka energije zračenjem. Štaviše, ovaj model je daokontinuirani, a ne diskretni spektri emisije atoma.
TEORIJA ATOMA BORA.
Sljedeći važan korak in razvoj teorije atoma obavio je Niels Bohr.
Najvažnija hipoteza koju je iznio Bohr u 1913. godine pojavila se hipoteza o diskretnoj strukturi
energetski nivoi elektrona u atomu. Ova pozicija ilustrovano o energiji
dijagrami. Tradicionalno, energija na dijagramima, energija se taloži duž vertikale
sjekire. Razlika između kretanja tijela u gravitacionom poljuod kretanja elektrona u atomuprema Borovoj hipotezi jeda se energija tijela može kontinuirano mijenjati,a energija elektrona na negativnim vrijednostimamože poprimiti brojne diskretne vrijednosti,prikazano na slici kao plavi segmentiboje. Ove diskretne vrijednosti su nazvanenivoa energije ili, inače, energije nivoa. Naravno, ideja o diskretnim nivoima energijepreuzeto je iz Planckove hipoteze. Promjena energijeelektron u skladu s Borovom teorijom mogaonastaju samo u skoku (sa jednog energetskog nivoa drugo). Borova teorija je savršeno objasnila karakter linije
atomski spektri. Međutim, na pitanje o razlogu diskretnosti
nivoa, teorija zapravo nije dala odgovor.
TALASNI SUPSTANCI.
Sljedeći korak u razvoju teorije mikrosvijeta bio je napravio Louis de Broglie. 1924. on je to predložiokretanje mikročestica se mora opisati ne kao klasično mehaničko
kretanje, već kao neka vrsta talasnog kretanja. To je iz zakona talasnog kretanja moraju se dobiti recepti za izračunavanje razlikadruge uočljive veličine. Tako u nauci, zajedno sa elektromagnetnim talasimapolja pojavili talasi materije.Hipoteza o talasnoj prirodi kretanja čestica bila je hrabra kaokao i Plankova pretpostavka o diskretnim svojstvima polja. eksperiment,direktno potvrđuje hipotezuBroglie, isporučen je tek 1927. godine.U ovom eksperimentu je uočenodifrakcija elektrona na kristalu,poput elektromagnetne difrakcije talasi. Dozvoljena je hipoteza o talasima materijeobjasniti diskretnu prirodu
nivoi energije. Iz teorije talasa, bilo je poznato da talas ograničen u prostoru uvek imadiskretne frekvencije. Primjer je talas u takvom mjuzikluinstrument kao flauta. Frekvencija zvuka u ovom slučaju je određenadimenzije prostora kojim je talas ograničen (dimenzije flaute).Ispostavilo se da je ovo opšte svojstvo talasa.Ali u skladu s Planckovom hipotezom, elektromagnetna kvantna frekvencijatalasi su proporcionalni energiji kvanta. Dakle, energija elektronamora uzeti diskretne vrijednosti.De Broljeva ideja se pokazala veoma plodnom, iako je, kao što je već pomenuto,direktni eksperiment koji potvrđuje valna svojstva elektrona, izvršeno je tek 1927. godine. Erwin Schrödinger je 1926. izveo jednačinu,kojoj se elektronski talas mora povinovati, i, rešivši ovojednadžba primijenjena na atom vodonika, dobila je sve rezultate kojibio u stanju dati Borovu teoriju. Zapravo, ovo je bio početakmoderna teorija opisivanje procesa u mikrokosmosu, jertalasna jednačina je lako generalizovana za različite sisteme - višeelektronskeatomi, molekuli, kristali.Razvoj teorije doveo je do shvaćanja da val odgovaračestica, određuje vjerovatnoću pronalaženja čestice u datoj tačkisvemir. Tako je koncept vjerovatnoće ušao u fiziku mikrosvijeta.Prema nova teorija val koji odgovara čestici u potpunosti određujekretanje čestica. Ali opšta svojstva talasa su takva da talasne može se lokalizovati ni u jednoj tački u prostoru, tj. besmislenogovoriti o koordinatama čestice u datom trenutku.Posljedica toga je bilo potpuno isključenje iz fizike mikrosvijeta takvihkoncepte kao što su putanja čestice i orbita elektronaatom. Prekrasan i vizualan planetarni model atoma, kako se ispostavilo,
Nedostaci Borove teorije ukazali su na potrebu revizije temelja kvantna teorija i ideje o prirodi mikročestica (elektrona, protona, itd.). Postavilo se pitanje koliko je iscrpan prikaz elektrona u obliku male mehaničke čestice, koju karakteriziraju određene koordinate i određena brzina.
Već znamo da se u optičkim fenomenima uočava neka vrsta dualizma. Uz fenomene difrakcije, interferencije (talasne pojave), uočavaju se i pojave koje karakterišu korpuskularnu prirodu svjetlosti (fotoelektrični efekat, Comptonov efekat).
Godine 1924. Louis de Broglie je to pretpostavio dualizam nije samo karakteristika optički fenomeni ,ali je univerzalan. Čestice materije takođe imaju talasna svojstva .
„U optici“, pisao je Louis de Broglie, „stoleće je korpuskularna metoda razmatranja bila previše zanemarena u poređenju sa talasom; Da li je u teoriji materije napravljena obrnuta greška? Pod pretpostavkom da čestice materije, uz korpuskularna svojstva, imaju i valna svojstva, de Broglie je na slučaj čestica materije prenio ista pravila za prijelaz sa jedne slike na drugu, koja vrijede i u slučaju svjetlosti.
Ako foton ima energiju i impuls, onda čestica (na primjer, elektron) koja se kreće određenom brzinom ima valna svojstva, tj. kretanje čestica se može smatrati kretanjem talasa.
Prema kvantnoj mehanici, slobodno kretanje čestice s masom m i impuls (gdje je υ brzina čestice) se može predstaviti kao ravan monokromatski talas ( de Broglie talas) sa talasnom dužinom
| (3.1.1) |
koji se širi u istom smjeru (na primjer, u smjeru ose X) u kojem se čestica kreće (slika 3.1).

Ovisnost valne funkcije o koordinatama X je data formulom
| , | (3.1.2) |
gdje - talasni broj ,a talasni vektor usmjereno u smjeru širenja valova ili duž kretanja čestice:
| . | (3.1.3) |
dakle, talasni vektor monohromatskog talasa povezan sa mikročesticama koje se slobodno kreću, proporcionalno njegovom momentu ili obrnuto proporcionalno njegovoj talasnoj dužini.
Budući da je kinetička energija čestice koja se relativno sporo kreće , tada se i talasna dužina može izraziti kao energija:
| . | (3.1.4) |
Kada čestica stupi u interakciju s nekim objektom - s kristalom, molekulom itd. – mijenja se njegova energija: dodaje joj se potencijalna energija ove interakcije, što dovodi do promjene u kretanju čestice. Shodno tome, priroda širenja talasa povezanog sa česticom se menja, a to se dešava prema principima zajedničkim za sve talasne pojave. Stoga se osnovne geometrijske pravilnosti difrakcije čestica ni na koji način ne razlikuju od pravilnosti difrakcije bilo kojeg talasa. Opšti uslov za difrakciju talasa bilo koje prirode je uporedivost upadne talasne dužine λ sa udaljenosti d između centara raspršenja: .
Hipoteza Louisa de Brogliea bila je revolucionarna, čak i za ono revolucionarno doba nauke. Međutim, to je ubrzo potvrđeno brojnim eksperimentima.
Kvantna mehanika je moderna teorija koja uspostavlja način opisivanja i zakone kretanja mikročestica (elementarnih čestica, atoma, molekula, jezgara) i njihovih sistema. Neobičnost kvantnomehaničkih koncepata u poređenju sa klasičnom fizikom otvorila je period razbijanja osnovnih fizičkih modela, koji su izgledali očigledni i neuništivi. To se uglavnom ticalo koncepta čestice i principa njenog kretanja.
Ovo poglavlje daje koncept ne samo o kvantnoj mehanici, već i o onim idejama i eksperimentima koji su doveli do ove teorije. Elektronska mikroskopija se smatra metodom zasnovanom na valnim svojstvima elektrona.
28.1. DE BROYLEOVA HIPOTEZA. EKSPERIMENTI NA DIFRAKCIJI ELEKTRONA I DRUGIH ČESTICA
Važan korak u stvaranju kvantne mehanike bilo je otkriće valnih svojstava mikročestica. Ideju o svojstvima talasa prvobitno je kao hipotezu izneo francuski fizičar Louis de Broglie (1924) 1 .
U fizici je dugi niz godina dominirala teorija prema kojoj je svjetlost elektromagnetski talas. Međutim, nakon rada Plancka (toplotno zračenje), Einsteina (fotoelektrični efekat) i drugih, postalo je očigledno da svjetlost ima korpuskularna svojstva.
1 De Broglieova hipoteza je formulirana prije eksperimenata koji potvrđuju valna svojstva čestica. De Broglie je o tome pisao kasnije, 1936. godine, na sljedeći način: „... ne možemo li pretpostaviti da je elektron dualan kao svjetlost? Na prvi pogled, ova ideja je delovala veoma smelo. Na kraju krajeva, oduvijek smo zamišljali elektron kao električno nabijen materijalna tačka, koji poštuje zakone klasične dinamike. Elektron nikada nije eksplicitno pokazivao valna svojstva kao što je, recimo, svjetlost u fenomenima interferencije i difrakcije. Pokušaj pripisivanja valnih svojstava elektronu, kada za to nema eksperimentalnih dokaza, mogao bi izgledati kao nenaučna fantazija.”
U pogl. 24 primjećeno je da se difrakcija rendgenskih zraka opaža na kristalnim tijelima; stoga se kristalne supstance moraju koristiti i za difrakciju elektrona.
K. Davisson i L. Germer su prvi uočili difrakciju elektrona na jednom kristalu nikla, J.P. Thomson i, nezavisno od njega, P.S. Tartakovski - na metalnoj foliji (polikristalno tijelo).

Na sl. 28.1 prikazuje elektronski gram - difrakcijski uzorak dobijen interakcijom elektrona sa polikristalnom folijom.
Upoređujući ovu sliku sa sl. 24.21, može se uočiti sličnost difrakcije elektrona i rendgenskih zraka.
Druge čestice također imaju sposobnost difrakcije, kako nabijene (protoni, joni, itd.) tako i neutralne (neutroni, atomi, molekuli).
Slično analizi difrakcije rendgenskih zraka, difrakcija čestica se može koristiti za određivanje uređenog ili neuređenog rasporeda atoma i molekula tvari i za procjenu parametara kristalnih rešetki.
Trenutno se široko koriste metode difrakcije elektrona (difrakcija elektrona) i difrakcije neutrona (neutronska difrakcija).
Mogu se postaviti pitanja: šta se dešava sa pojedinačnim česticama, kako nastaju maksimumi i minimumi tokom difrakcije pojedinačnih čestica?
Eksperimenti na difrakciji elektronskih snopova vrlo niskog intenziteta, tj. kao da su odvojene čestice, pokazao da u ovom slučaju elektron nije "razmazan" u različitim smjerovima, već se ponaša kao cijela čestica. Međutim, vjerojatnost otklona elektrona u različitim smjerovima kao rezultat interakcije s objektom difrakcije je različita. Najvjerovatnije je da će elektroni pogoditi mjesta koja, prema proračunu, odgovaraju difrakcijskim maksimumima, manje je vjerovatno da će njihov udar u minimume. Dakle, valna svojstva su svojstvena ne samo kolektivu elektrona, već i svakom elektronu pojedinačno.
28.2. ELEKTRONSKI MIKROSKOP. POJAM ELEKTRONSKE OPTIKE
Talasna svojstva čestica mogu se koristiti ne samo za difrakcijsku strukturnu analizu, već i za dobijanje uvećanih slika objekta.
Iz (26.19) proizilazi da je granica rezolucije optičkog mikroskopa uglavnom određena graničnom vrijednošću valne dužine svjetlosti koju percipira ljudsko oko. Zamjenjujući u ovu formulu vrijednost de Broglie talasne dužine (28.3), nalazimo granicu rezolucije elektronskog mikroskopa, u kojoj sliku objekta formiraju elektronski snopovi:
Lako je vidjeti da je rezolucija granica z elektronski mikroskop zavisi od napona ubrzanja, a može se postići da je mnogo manji, a rezolucija mnogo veća od one kod optičkog mikroskopa.
Elektronski mikroskop i njegovi pojedinačni elementi slični su po namjeni optičkom, pa ćemo koristiti analogiju da objasnimo njegovu strukturu i princip rada. Dijagrami oba mikroskopa su prikazani na sl. 28.2 (a - optički; b - elektronski).
U optičkom mikroskopu, nosilac informacija o subjektu AB je foton, svjetlost. Izvor svjetlosti je obično žarulja sa žarnom niti /. Nakon interakcije s objektom (apsorpcija, raspršivanje, difrakcija), tok fotona se transformira i sadrži informacije o objektu. Tok fotona se formira pomoću optičkih uređaja, uglavnom sočiva: kondenzator 3, objektiv 4, okular 5. Slika A 1 B 1 se snima okom 7 (ili fotografskom pločom, fotoluminiscentnim ekranom itd.).
U elektronskom mikroskopu, nosilac informacije o objektu je elektron, a izvor elektrona je zagrijana katoda 1. Ubrzanje elektrona i formiranje snopa vrši se pomoću elektrode za fokusiranje i anoda - sistema koji se naziva elektronski top 2. Nakon interakcije s objektom (uglavnom raspršivanja), tok elektrona se pretvara i sadrži informacije o subjektu. Do formiranja toka elektrona dolazi pod uticajem električno polje(sistem elektroda i kondenzatora) i magnetni (sistem-

ma kalemovi sa strujom). Ovi sistemi se nazivaju elektronskim sočivima po analogiji sa optičkim sočivima koje formiraju svetlosni tok. (3 - kondenzator; 4 - elektronski, služi kao sočivo, 5 - projekcija). Slika se snima na fotografsku ploču osjetljivu na elektrone ili katodoluminiscentni ekran 6.
Da bismo procijenili granicu rezolucije elektronskog mikroskopa, zamijenimo u formulu (28.4) ubrzavajući napon od 100 kV i ugaoni otvor reda reda 10 -2 rad (približno takvi uglovi se koriste u elektronskoj mikroskopiji). Onda dobijamo z ~ 0,1 nm, što je stotine puta bolje od optičkih mikroskopa. Upotreba ubrzavajućeg napona većeg od 100 kV, iako povećava rezoluciju, povezana je s određenim poteškoćama, posebno se javlja
uništavanje objekta koji se proučava elektronima koji imaju veliku brzinu. U praksi, čak i sa najboljim elektronskim mikroskopom, može se postići granica rezolucije reda od 10 -10 m; ovo je stotine puta bolje od optičkih mikroskopa.
Prednosti elektronskog mikroskopa uključuju veliku rezoluciju koja omogućava razmatranje velikih molekula, mogućnost promjene, ako je potrebno, napona ubrzanja i, posljedično, granice rezolucije, te relativno zgodnu kontrolu toka elektrona pomoću magnetnih i električnih polja. .
Naznačimo neke karakteristike rada elektronskog mikroskopa. U onim njegovim dijelovima gdje elektroni lete, mora postojati vakuum, jer će inače sudar elektrona sa molekulima zraka (plina) dovesti do izobličenja slike. Ovaj zahtjev za elektronsku mikroskopiju komplikuje proceduru ispitivanja, čini opremu glomaznijom i skupljom. Vakum iskrivljuje izvorna svojstva bioloških objekata, au nekim slučajevima ih uništava ili deformiše.
Samo vrlo tanki rezovi su pogodni za gledanje u elektronskom mikroskopu, budući da su elektroni jako apsorbirani i raspršeni supstancom. Stoga je u nekim slučajevima preporučljivo napraviti otisak ispitivane površine predmeta na tankom sloju plastike. Ovaj postupak se zove replikacija, a plastična kopija površine je replika.

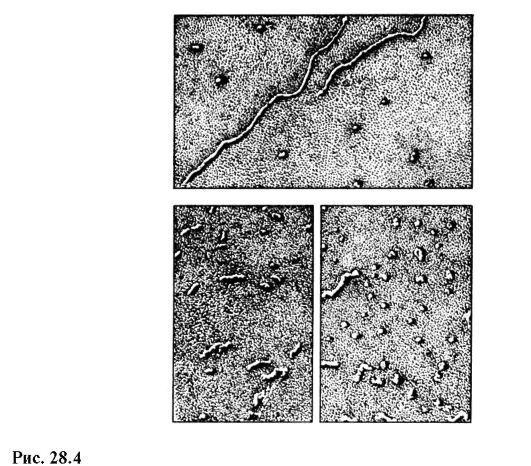
Savremeni domaći elektronski mikroskop EVM-100 LM (slika 28.3) daje maksimalno uvećanje od 600.000 puta i garantovanu granicu rezolucije od 3? 10 -10 m. Na sl. 28.4 prikazuje slike molekula RNK u različitim stanjima, dobijene na elektronskom mikroskopu sa uvećanjem od 100.000 puta.
Prisustvo valnih i korpuskularnih svojstava fotona i elektrona i drugih čestica omogućava da se prošire brojne odredbe i zakoni optike kako bi se opisali kretanje nabijenih čestica u električnim i magnetskim poljima.
Ova analogija omogućila je izdvajanje kao samostalnu sekciju elektronska optika - polje fizike u kojem se proučava struktura snopova nabijenih čestica u interakciji s električnim i magnetskim poljima. Kao i konvencionalna optika, elektronska se može podijeliti na geometrijski (greda) i talas(fizički).
U okviru geometrijske elektronske optike posebno je opisano kretanje nabijenih čestica u električnim i magnetskim poljima. Šematski prikaz slike u elektronskom mikroskopu (vidi sliku 28.2, b) zasniva se na geometrijskoj elektronskoj optici.
Pristup talasne elektronske optike je bitan u slučaju kada se manifestuju valna svojstva naelektrisanih čestica. Dobra ilustracija je pronalaženje rezolucije (granice rezolucije) date na početku pasusa.
28.3. TALASNA FUNKCIJA I NJEGOVO FIZIČKO ZNAČENJE
Budući da je mikročestica povezana s valnim procesom koji odgovara njenom kretanju, stanje čestica u kvantnoj mehanici opisuje se valnom funkcijom koja ovisi o koordinatama i vremenu: ψ(χ, y, z, t).
Ako je polje sile koje djeluje na česticu nepokretno, tj. neovisno o vremenu, onda se ψ-funkcija može predstaviti kao proizvod dva faktora, od kojih jedan ovisi o vremenu, a drugi o koordinatama:
U nastavku ćemo razmatrati samo stacionarna stanja; ψ-funkcija je vjerovatnoća karakteristika stanja čestice. Hajde da objasnimo značenje ove izjave.
Dodijelimo dovoljno mali volumen u prostoru dV= dxdjdz, unutar kojeg se vrijednosti ψ-funkcije mogu smatrati istim. Vjerovatnoća nalaženja dW Bčestica u ovom volumenu je proporcionalna zapremini i zavisi od kvadrata modula ψ-funkcije:

Kvadrat modula valne funkcije jednak je gustoći vjerovatnoće, tj. omjer vjerovatnoće pronalaska čestice u zapremini prema ovoj zapremini.
Integrirajući izraz (28.6) preko nekog volumena V, nalazimo vjerovatnoću pronalaska čestice u ovom volumenu:
28.4. ODNOSI NESIGURNOSTI
Jedna od važnih odredbi kvantne mehanike su relacije nesigurnosti koje je predložio W. Heisenberg.
Neka se istovremeno mjere položaj i impuls čestice, dok su netačnosti u definiciji apscise i projekcije momenta na osu apscise Δχ i Δr x, respektivno.

1 Zaista je nemoguće izvesti takav eksperiment, budući da dimenzije jaza moraju biti reda atoma, stoga se opisuje neki mentalni eksperiment.

Rješenje (28.11) znači da što je kraće vrijeme postojanja nekog stanja sistema, to je nesigurnija njegova vrijednost energije. Energetski nivoi E 1 , E 2 itd. imaju određenu širinu (slika 28.6), u zavisnosti od vremena kada je sistem u stanju koje odgovara ovom nivou.
“Zamućenje” nivoa dovodi do nesigurnosti energije AE emitovanog fotona i njegove frekvencije Ay tokom prelaska sistema sa jednog energetskog nivoa na drugi:
Kako je stanje mikročestice opisano ψ-funkcijom, potrebno je navesti metodu za pronalaženje ove funkcije, uzimajući u obzir vanjske uslove. To je moguće kao rezultat rješavanja osnovne jednadžbe kvantne mehanike koju je predložio E. Schrödinger (1926). Takva se jednadžba postulira u kvantnoj mehanici na isti način kao što je drugi Newtonov zakon postuliran u klasičnoj mehanici.
Kako se primjenjuje na stacionarna stanja, Schrödingerova jednačina se može napisati na sljedeći način:
Ovo se manifestuje u širenju spektralnih linija.
28.5. SCHROEDINGEROVA JEDNAČINA. ELEKTRON U POTENCIJALNOM BUNARU
gdje m- masa čestica; E i E p su njene ukupne i potencijalne energije (potencijalna energija je određena poljem sila u kojem se čestica nalazi, a za stacionarni slučaj ne zavisi od vremena).
Ako se čestica kreće samo duž neke linije, na primjer duž ose X(jednodimenzionalni slučaj), tada je Schrödingerova jednadžba značajno pojednostavljena i poprima oblik:
Jedan od najjednostavnijih primjera upotrebe Schrödingerove jednadžbe je rješenje problema kretanja čestice u jednodimenzionalnoj potencijalnoj bušotini.
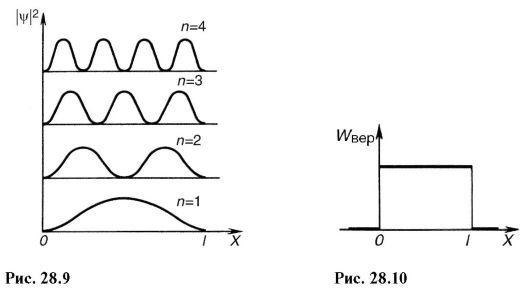
Neka se elektron kreće duž ose X samo unutar 0< X < l(Sl. 28.7). To znači da je u naznačenom intervalu ψ-funkcija različita od nule, a izvan intervala (x<0, X>l) jednako je nuli.
Budući da polja sila ne djeluju na česticu u odabranom intervalu, njena potencijalna energija može imati bilo koju konstantnu vrijednost (najpogodnije je uzeti E str= 0). Izvan ovog intervala nema elektrona, pa njegovu potencijalnu energiju treba smatrati beskonačno velikom. Na sl. 28.7 prikazuje grafičku zavisnost E p = D x). Interval 0< X < l, удовлетворяющий сформулированным выше условиям, называют одномерной прямоугольной potencijalni bunar sa beskonačno visokim zidovima. Uz razmatranje E str= 0 Schrödingerova jednadžba (28.14) za interval 0< X < l izgleda kao:

Ova jednadžba je slična diferencijalna jednadžba harmonijska oscilacija (vidi 7.1) čije je rješenje:

Prije svega, važno je napomenuti da rješenje Schrödingerove jednadžbe za elektron u potencijalnoj bušotini bez ikakvih dodatnih postulata dovodi do diskretnih, kvantiziranih vrijednosti energije:

Iz (28.21) se može vidjeti da za neku fiksnu vrijednost n diskretnost, tj. razlika u energijama susednih nivoa je manja, što je veća veličina potencijalnog bunara. Na primjer, razmotrite dva slučaja n = 1:
1) l= 5? 10 -10 m, što otprilike odgovara veličini atoma; onda ΔΕ = 4,5 eV. Ovo se po redu veličine podudara sa vrijednostima dobivenim za atom vodika prema Bohrovoj teoriji;
2) l= 10 -1 m, što zapravo odgovara takvoj širini potencijalne jame da se elektron može smatrati slobodnim; pri čemu ΔΕ = 1.1? 10 -16 eV. Ovdje je diskretnost zanemarljiva i praktično se može smatrati da se energija elektrona kontinuirano mijenja.
Kvadrirajući (28.20), dobijamo gustinu verovatnoće |ψ| 2 pronalaženje elektrona u različitim tačkama potencijalne bušotine. Na sl. 28.9 prikazuje grafičku zavisnost |ψ| 2 off χ u različitim diskretnim stanjima, tj. različite kvantne brojeve. Kao što se može vidjeti sa slike, elektron može biti na različitim mjestima potencijalne bušotine s različitim vjerovatnoćama. Postoje tačke u kojima je vjerovatnoća pronalaska elektrona općenito jednaka nuli. Ovo se značajno razlikuje od ideja klasične fizike, prema kojima je jednako vjerovatno da se čestica nalazi na različitim mjestima potencijalne bušotine (slika 28.10) i nemoguće je podijeliti bunar tačkama u kojima je prisutna čestica je isključena.
Schrödingerova jednačina se također može primijeniti na složenija polja sile, kao što je elektron u atomu. To će dovesti do dodatnih matematičkih poteškoća, ali neće promijeniti glavne karakteristike.
atomski sistemi: diskretnost energetskih stanja, probabilistički sudovi o pronalaženju elektrona, vrsta zavisnosti |ψ| 2 iz koordinata, itd.
28.6. PRIMJENA SCHROEDINGEROVE JEDNAČINE NA ATOM VODIKA. KVANTNI BROJEVI
Opisivanje stanja atoma i molekula pomoću Schrödingerove jednadžbe je prilično težak zadatak. Najjednostavnije se rješava za jedan elektron koji se nalazi u polju jezgra. Takvi sistemi odgovaraju atomu vodika i jonima sličnim vodoniku (jednostruko jonizovani atom helijuma, dvostruko jonizovani atom litijuma, itd.). Međutim, i u ovom slučaju rješenje problema je izvan okvira našeg kursa, pa se ograničavamo na kvalitetan prikaz problematike.
Prije svega, potencijalnu energiju treba zamijeniti u Schrödingerovu jednačinu (28.13), koja za dva naboja u međusobnoj interakciji - e(elektron) i Ze(jezgro), - nalazi se na udaljenosti r u vakuumu, izražava se na sljedeći način:
Sa centralnom simetrijom polja koje stvara jezgro, prikladnije je riješiti problem ne u kartezijanskim pravokutnim koordinatama, već u sfernim r, θ i p.
Rješenje Schrödingerove jednadžbe nalazi se kao proizvod tri funkcije, od kojih svaka ovisi o jednoj varijabli:
Baš kao i za elektron u pravougaonoj potencijalnoj bušotini sa beskonačno visokim zidovima granični uslovi dovelo do specifičnih mogućih vrijednosti ψ i energije, au potencijalnoj bušotini koja odgovara atomu vodika, fizički uvjeti dovode do mogućih vrijednosti f1, f 2 , f 3 a time i ψ-funkcije. Ovde se takođe manifestuje glavna karakteristika kvantno-mehaničkih sistema - diskretnost stanja.
Diskretnost matematički leži u činjenici da bilo koja od funkcija jednačine (28.23) ima čitav skup (spektar) rješenja, od kojih svako odgovara određenom kvantnom broju. Za razliku od pravougaone potencijalne bušotine sa beskonačno visokim zidovima, stanje elektrona u atomu karakteriše ne jedan, već nekoliko kvantnih brojeva 1 . Prvi od njih - glavni kvantni broj P - 1, 2, 3... Određuje energetske nivoe elektrona prema zakonu:

Ovaj izraz je rješenje Schrödingerove jednadžbe i potpuno se poklapa sa odgovarajućom formulom Borove teorije (vidi 28.7).
Na sl. 28.11 prikazani su nivoi mogućih vrijednosti ukupne energije atoma vodika (E 1, E 2, E 3, itd.) i graf zavisnosti potencijalna energija E P iz daljine r između elektrona i jezgra [vidi (28.22)]. Kako se glavni kvantni broj povećava P povećava r[vidi, na primjer, (28.33)], i kompletan [vidjeti. (28.24)] i potencijalna energija teži nuli. Kinetička energija takođe teži nuli. Osjenčano područje (E > 0) odgovara stanju slobodnog elektrona.
1 U opštem slučaju, kvantni brojevi su celi brojevi (0, 1, 2...) ili poluceli (1/2, 3/2, 5/2...) brojevi koji definišu moguće diskretne vrednosti fizičke veličine, koji karakterišu kvantne sisteme i elementarne čestice.

1 Prisustvo spina u česticama ne slijedi iz Schrödingerove jednačine.
sa ovim proračunom: više vremena je bilo na mestima sa većom gustinom verovatnoće, manje dugo - na mestima sa manjom gustinom verovatnoće. Kao rezultat ekspozicije na filmu, dobijena su mjesta različitog intenziteta koja ilustruju raspodjelu elektrona u atomu. Iz slika se vidi koliko je koncept „orbite“ uslovljen, pa čak i netačan u odnosu na kretanje elektrona.
Spin i orbitalni magnetni momenti međusobno djeluju, što mijenja sistem energetskih nivoa atoma u odnosu na onaj koji bi bio bez takve interakcije. Rečeno je da interakcija spin-orbita dovodi do fine strukture nivoi energije. Ako je značajan, onda je potrebno uzeti u obzir ukupni ugaoni moment elektrona - orbitala plus spin. U međuvremenu, umjesto m l i gospođa koristite druge kvantne brojeve: j i nij.
kvantni broj j- orbitalni plus spin - određuje diskretne vrijednosti ukupnog ugaonog momenta L elektron:

Magnetski kvantni broj m) karakteriše moguće projekcije ukupnog ugaonog momenta na neki proizvoljno odabrani pravac Z:
Za dato l kvantni broj j uzima dvije vrijednosti: ±1/2
(Tabela 28.1).
Tabela 28.1

Za dato j kvantni broj nij uzima 2j + 1 vrijednosti: -j, -j + 1 ... + j.
28.7. KONCEPT TEORIJE BORA
Čak i prije stvaranja kvantne mehanike 1913. godine, danski fizičar N. Bohr predložio je teoriju o atomu vodika i jonima sličnim vodiku, koja se temeljila na nuklearnom modelu atoma i njegova dva postulata. Borovi postulati nisu se uklapali u okvire klasične fizike.
Prema prvom postulatu, atom i atomski sistemi mogu dugo ostati samo u određenim stacionarnim stanjima. U takvim stanjima atom ne emituje niti apsorbuje energiju. Stacionarna stanja odgovaraju diskretnim energetskim vrijednostima: E 1, E 2...
Svaka promjena energije atoma ili atomskog sistema povezana je s naglim prijelazom iz jednog stacionarnog stanja u drugo.
Prema drugom postulatu, prilikom prelaska atoma iz jednog stanja u drugo, atom emituje ili apsorbuje foton čija je energija određena jednačinom (29.1).
Prelazak iz stanja sa višom energijom u stanje sa nižom energijom praćen je emisijom fotona. Obrnuti proces je moguć kada se foton apsorbuje.
Prema Bohrovoj teoriji, elektron u atomu vodika okreće se kružnom orbiti oko jezgra. Od svih mogućih orbita, stacionarna stanja odgovaraju samo onima za koje je ugaoni moment cijeli broj h/(2π):
(n = 1, 2, 3...), (28.31)
gdje m- masa elektrona; υ η - njegova brzina uključena n-ta orbita; rn je njegov radijus. Na elektron koji rotira po kružnoj orbiti u atomu djeluje Kulonova sila privlačenja sa strane pozitivno nabijenog jezgra, koja je, prema drugom Newtonovom zakonu, jednaka proizvodu mase elektrona za centripetalno ubrzanje(dat zapis za vakuum):

Uprkos velikom uspjehu Borove teorije, njeni nedostaci ubrzo su postali očigledni. Dakle, u okviru ove teorije nije bilo moguće objasniti razliku u intenzitetima spektralnih linija, tj. odgovorite na pitanje zašto su neke energetske tranzicije vjerovatnije od drugih. Borova teorija nije otkrila spektralne obrasce složenijeg atomskog sistema - atoma helijuma (dva elektrona koji se okreću oko jezgra).
Nedostatak Borove teorije bila je njena nedosljednost. Ova teorija nije bila ni klasična ni kvantna, ona je kombinovala odredbe fundamentalno različitih teorija: klasične i kvantne fizike. Tako se, na primjer, u Borovoj teoriji vjeruje da se elektron rotira u atomu u određenoj orbiti (klasične reprezentacije), ali ne emituje elektromagnetski val (kvantne reprezentacije).
U prvoj četvrtini našeg veka postalo je jasno da Borova teorija mora biti zamenjena drugom teorijom atoma. Pojavila se kvantna mehanika.
28.8. ELEKTRONSKE LJUSKE SLOŽENIH ATOMA
Kvantni brojevi koji opisuju stanje elektrona u atomu vodika koriste se za aproksimaciju stanja pojedinačnih elektrona u kompleksnim atomima. Međutim, treba uzeti u obzir najmanje dvije značajne razlike između kompleksnih atoma i atoma vodika:
1) u kompleksnim atomima, energija elektrona, zbog njihove interakcije, zavisi ne samo od n, već i od /;
2) razlika je zbog Paulijevog principa, prema kojem atom ne može imati dva (ili više) elektrona sa četiri identična kvantna broja.
U formiranju elektronske konfiguracije koja odgovara normalnom stanju, svaki elektron atoma teži da ima najnižu energiju. Da nije bilo Paulijevog principa, tada bi svi elektroni bili smješteni na najnižem energetskom nivou. U stvari, uz neke izuzetke, elektroni zauzimaju niz stanja koji je naznačen za atom vodonika u tabeli. 29.
Elektroni sa istim glavnim kvantnim brojem formiraju sloj. Slojevi se nazivaju DO, L M, N itd. u skladu sa n= 1, 2, 3, 4... Elektroni koji imaju iste parove vrijednosti n i / , su dio ljuske, što se ukratko označava na isti način kao i odgovarajuća stanja za elektron atoma vodika: 1s, 2s, 2^, itd. Tako se, na primjer, nazivaju ljuska 2s, 2s elektroni itd.
Broj elektrona u ljusci je naznačen u gornjem desnom uglu pored simboličke oznake ljuske, na primjer 2p 4 .
Raspodjela elektrona preko ljuski u atomu (elektronske konfiguracije) obično se označava na sljedeći način: za dušik 1s 2, 2s2, 2p 3, za kalcijum 1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2, itd.
Budući da energija elektrona složenih atoma ne zavisi samo od n, već i od l, onda se konstrukcija periodnog sistema ne dešava uvek postepenim popunjavanjem slojeva kako atom postaje složeniji. Za kalij (Z = 19), na primjer, umjesto punjenja sloja M(moglo je biti 1s 2 , 2s 2 , 2^ 6 , 3s 2 , 3p 6, 3a 1) počinje punjenje sloja N i kreira se sljedeća elektronska konfiguracija: 1 s2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 1.
I ostali elementi imaju slična odstupanja od redovnog punjenja slojeva.
Opće pravilo je uvijek ispunjeno: elektroni nepobuđenog atoma zauzimaju stanje s najnižom energijom iu skladu s Paulijevim principom. Na sl. 28.13 shematski, bez obzira na razmjer, prikazana su energetska stanja kompleksnog atoma i odgovarajući broj elektrona.
U zaključku, napominjemo da je stanje višeelektronskog atoma u cjelini određeno sljedećim kvantnim brojevima: L- ukupni orbitalni moment atoma, koji poprima vrijednosti 0, 1, 2, 3, itd. jedan ; J- ukupan moment atoma, koji može uzeti vrijednosti sa intervalom od jedan od |L - S| do |L + S |; S- rezultirajući spin moment atoma; magnetna m J , koji određuje diskretne vrijednosti projekcije ukupnog impulsa atoma na neku osu Z:

Za dato Jm J uzima 2 J+ 1 vrijednosti:
-J, -J+ 1 ... +J.
1 Nemojte brkati ovu oznaku sa nazivom elektronskog sloja L i sa ukupnim ugaonim momentom elektrona.
28.9. ENERGETSKI NIVOI MOLEKULA
Budući da se molekule sastoje od atoma, unutarmolekulsko kretanje je složenije od intraatomskog kretanja. U molekuli, pored kretanja elektrona u odnosu na jezgra, oscilirajuće kretanje atoma oko njihovog ravnotežnog položaja (vibracija jezgara zajedno sa elektronima koji ih okružuju) i rotacijskog kretanja molekula kao cjeline.
Elektronski, oscilatorni i rotacionim pokretima molekuli odgovaraju tri tipa nivoa energije: E el, E count i E time. Prema kvantnoj mehanici, energija svih vrsta kretanja u molekulu ima samo diskretne vrijednosti (kvantizirane). Predstavimo približno ukupnu energiju E molekule kao zbir kvantiziranih vrijednosti energija različitih tipova:
E\u003d E el + E count + E vrijeme. (28.37)
Na sl. 28.14 šematski prikazuje sistem nivoa molekula: udaljeni elektronski energetski nivoi a" i a"", za koji je E count = E vr = 0; bliže raspoređeni vibracioni nivoi v" , v"", za njih E r = 0; najbliže raspoređene rotacijske razine J" i J"" sa različitim vrijednostima E vremena.
Udaljenost između elektronskih energetskih nivoa je reda nekoliko elektron volti, između susjednih vibracionih nivoa 10 -2 -10 -1 eV, između susjednih rotacijskih nivoa 10 -5 -10 -3 eV.

Naravno, to možete nazvati glupošću,
ali sam sreo takve gluposti da u
u poređenju sa njom, ova se čini razumnom
rječnik.
L. Carroll
Šta je planetarni model atoma i koji je njegov nedostatak? Koja je suština Borovog modela atoma? Koja je hipoteza o valnim svojstvima čestica? Kakva predviđanja ova hipoteza daje o svojstvima mikrosvijeta?
Lekcija-predavanje
KLASIČNI MODELI ATOMA I NJIHOVI NEDOSTACI. Ideje da atomi nisu nedjeljive čestice i da sadrže elementarne naboje kao sastavne čestice prvi put su izražene krajem 19. stoljeća. Termin "elektron" predložio je 1881. engleski fizičar George Stoney. Godine 1897. elektronska hipoteza dobila je eksperimentalnu potvrdu u studijama Emila Wiecherta i Josepha Johna Thomsona. Od tog trenutka počinje stvaranje raznih elektronskih modela atoma i molekula.
Thomsonov prvi model je pretpostavio da je pozitivno naelektrisanje ravnomjerno raspoređeno po atomu, a elektroni su u njemu raspoređeni, poput grožđica u lepinji.
Neslaganje između ovog modela i eksperimentalnih podataka postalo je jasno nakon eksperimenta Ernesta Rutherforda 1906. godine, koji je proučavao proces raspršivanja α-čestica atomima. Iz iskustva se zaključilo da je pozitivni naboj koncentrisan unutar formacije, mnogo manji od veličine atoma. Ova formacija se zove atomsko jezgro, čije su dimenzije bile 10 -12 cm, a dimenzije atoma - 10 -8 cm.U skladu sa klasičnim idejama elektromagnetizma, Kulonova sila privlačenja mora da deluje između svakog elektrona i jezgra. Ovisnost ove sile o udaljenosti trebala bi biti ista kao u zakonu univerzalne gravitacije. Prema tome, kretanje elektrona u atomu mora biti slično kretanju planeta Sunčevog sistema. Tako je rođen planetarni model atoma Rutherford.
Kratki životni vijek atoma i kontinuirani spektar zračenja, koji proizilaze iz planetarnog modela, pokazali su njegovu nedosljednost u opisivanju kretanja elektrona u atomu.
Dalje proučavanje stabilnosti atoma dalo je zapanjujući rezultat: proračuni su pokazali da u vremenu od 10 -9 s, elektron mora pasti na jezgro zbog gubitka energije za zračenje. Osim toga, takav model je dao kontinuirane, a ne diskretne spektre emisije atoma.
TEORIJA ATOMA BORA. Sljedeći važan korak u razvoju teorije atoma napravio je Niels Bohr. Najvažnija hipoteza koju je iznio Bohr 1913. bila je hipoteza o diskretnoj strukturi energetskih nivoa elektrona u atomu. Ova pozicija je ilustrovana energetskim dijagramima (Sl. 21). Tradicionalno, energetski dijagrami prikazuju energiju duž vertikalne ose.
Rice. 21 Energija satelita u gravitacionom polju Zemlje (a); energija elektrona u atomu (b)
Razlika između kretanja tijela u gravitacionom polju (slika 21, a) i kretanja elektrona u atomu (slika 21, b) u skladu s Borovom hipotezom je u tome što energija tijela može kontinuirano promjena, a energija elektrona sa negativnim vrijednostima može uzeti niz diskretnih vrijednosti prikazanih na slici kao plavi segmenti. Ove diskretne vrijednosti su nazvane energetski nivoi ili, drugim riječima, energetski nivoi.
Naravno, ideja o diskretnim nivoima energije preuzeta je iz Planckove hipoteze. Promjena energije elektrona, prema Borovoj teoriji, mogla bi se dogoditi samo u skoku (s jednog energetskog nivoa na drugi). Tokom ovih prijelaza, kvant svjetlosti se emituje (prijelaz naniže) ili apsorbira (prijelaz naviše), čija je frekvencija određena Planckovom formulom hv = E quantum = ΔE atoma, tj. promjena energije atoma atom je proporcionalan frekvenciji emitovanog ili apsorbovanog svetlosnog kvanta.
Borova teorija je savršeno objasnila linijski karakter atomskih spektra. Međutim, teorija zapravo nije dala odgovor na pitanje o razlogu diskretnosti nivoa.
TALASNI SUPSTANCI. Sljedeći korak u razvoju teorije mikrosvijeta napravio je Louis de Broglie. Godine 1924. predložio je da kretanje mikročestica ne treba opisati kao klasično mehaničko kretanje, već kao neka vrsta talasnog kretanja. Iz zakona talasnog kretanja moraju se dobiti recepti za izračunavanje različitih uočljivih veličina. Tako su se u nauci, zajedno sa talasima elektromagnetnog polja, pojavili talasi materije.
Hipoteza o talasnoj prirodi kretanja čestica bila je hrabra kao i Plankova hipoteza o diskretnim svojstvima polja. Eksperiment koji je direktno potvrdio de Broglieovu hipotezu postavljen je tek 1927. godine. U ovom eksperimentu uočena je difrakcija elektrona na kristalu, slična difrakciji elektromagnetnog talasa.
Borova teorija bila je važan korak u razumijevanju zakona mikrosvijeta. Bio je prvi koji je uveo odredbu o diskretnim vrijednostima energije elektrona u atomu, što je odgovaralo iskustvu i kasnije postalo dio kvantne teorije.
Hipoteza o talasima materije omogućila je da se objasni diskretna priroda energetskih nivoa. Iz teorije talasa je bilo poznato da talas ograničen u prostoru uvek ima diskretne frekvencije. Primjer je talas u muzičkom instrumentu kao što je flauta. Frekvencija zvuka je u ovom slučaju određena dimenzijama prostora na koji je talas ograničen (dimenzija flaute). Ispostavilo se da je ovo opšte svojstvo talasa.
Ali u skladu sa Planckovom hipotezom, frekvencije kvanta elektromagnetnog talasa su proporcionalne energiji kvanta. Posljedično, energija elektrona također mora imati diskretne vrijednosti.
De Broglieova ideja se pokazala vrlo plodnom, iako je, kao što je već spomenuto, direktan eksperiment koji je potvrdio valna svojstva elektrona izveden tek 1927. atoma vodika, dobio je sve rezultate koje je Bohrova teorija mogla postići. davanje. Zapravo, ovo je bio početak moderne teorije koja opisuje procese u mikrosvijetu, budući da se valna jednadžba lako generalizirala za različite sisteme - atome sa više elektrona, molekule, kristale.
Razvoj teorije doveo je do shvatanja da talas koji odgovara čestici određuje verovatnoću pronalaženja čestice u datoj tački prostora. Tako je koncept vjerovatnoće ušao u fiziku mikrokosmosa
Prema novoj teoriji, val koji odgovara čestici u potpunosti određuje kretanje čestice. Ali opšta svojstva talasa su takva da se talas ne može lokalizovati ni u jednoj tački u prostoru, odnosno besmisleno je govoriti o koordinatama čestice u datom trenutku. Posljedica toga bila je potpuno isključenje iz fizike mikrokosmosa takvih koncepata kao što su putanja čestice i orbite elektrona u atomu. Prekrasan i vizualan planetarni model atoma, kako se ispostavilo, ne odgovara stvarnom kretanju elektrona.
Svi procesi u mikrokosmosu imaju vjerovatnoćan karakter. Proračunima se može odrediti samo vjerovatnoća da će se određeni proces desiti.
U zaključku, vratimo se na epigraf. Hipoteze o talasima materije i kvantima polja izgledale su kao besmislica mnogim fizičarima koji su odgajani na tradicijama klasične fizike. Činjenica je da su ove hipoteze lišene uobičajene vizualizacije koju imamo kada vršimo zapažanja u makrokosmosu. Međutim, kasniji razvoj nauke o mikrosvijetu doveo je do takvih ideja da ... (vidi epigraf paragrafa).
- Kojim eksperimentalnim činjenicama je Thomsonov model atoma bio u suprotnosti?
- Šta je ostalo od Borovog modela atoma u modernoj teoriji, a šta je odbačeno?
- Koje su ideje doprinijele de Broglieovoj hipotezi o talasima materije?