   |
|
| Sistematično Ime | benzen |
| Skraćenice | PhH |
| Tradicionalna imena | fen za kosu (Laurent, 1837.), fenil vodonik, benzen |
| Chem. formula | C₆H₆ |
| Država | tečnost |
| Molarna masa | 78,11 g/mol |
| Gustina | 0,8786 g/cm³ |
| Dinamički viskozitet | 0,0652 Pa s |
| Energija jonizacije | 9,24 ± 0,01 eV |
| T. topiti. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | −11° |
| T. svsp. | 562° |
| itd. blast | 1,2 ± 0,1 vol% |
| Pritisak pare | 75 ± 1 mmHg |
| Rastvorljivost u vodi | 0,073 g/100 ml |
| GOST | GOST 5955-75 |
| Reg. CAS broj | 71-43-2 |
| PubChem | 241 |
| Reg. EINECS broj | 200-753-7 |
| SMILES | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| CHEBI | 16716 |
| ChemSpider | 236 |
| Toksičnost | otrovan, ima kancerogena i narkotična svojstva |
| signalna riječ | OPASNO! |
| Podaci su dati za standardne uslove (25°, 100 kPa) osim ako nije drugačije naznačeno. | |
Hemijska svojstva
Za benzen su karakteristične supstitucijske reakcije - benzen reaguje sa alkenima, hloroalkanima, halogenima, azotnom i sumpornom kiselinom. Reakcije cijepanja benzenskog prstena odvijaju se u teškim uslovima (temperatura, pritisak).
- Interakcija s alkenima (alkilacija), kao rezultat reakcije nastaju homolozi benzena, na primjer, etilbenzen i kumen:
- Interakcija s hlorom i bromom u prisustvu katalizatora za stvaranje klorobenzena (reakcija elektrofilne supstitucije):
- U nedostatku katalizatora, kada se zagrije ili osvijetli, dolazi do radikalne reakcije adicije sa stvaranjem mješavine izomera heksahlorcikloheksana
- Kada benzen reaguje sa bromom u rastvoru oleuma, nastaje heksabromobenzen:
- Interakcija s halogenim derivatima alkana (alkilacija benzena, Friedel-Craftsova reakcija) za stvaranje alkilbenzena:

- Friedel-Craftsova reakcija acilacije benzen anhidrida, halogenida karboksilne kiseline dovodi do stvaranja aromatičnih i masnih aromatičnih ketona:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
U prvoj i drugoj reakciji nastaje acetofenon (metilfenil keton), zamjena aluminijum hlorida antimon hloridom omogućava da se temperatura reakcije smanji na 25 °C. U trećoj reakciji nastaje benzofenon (difenil keton).
- Reakcija formilacije - interakcija benzena sa mješavinom CO i HCl, odvija se pod visokim tlakom i pod djelovanjem katalizatora, proizvod reakcije je benzaldehid:
- Reakcije sulfoniranja i nitriranja (elektrofilna supstitucija):
- Redukcija benzena vodonikom (katalitička hidrogenacija):
Reakcije oksidacije
Benzen je, zbog svoje strukture, vrlo otporan na oksidaciju, na njega ne utiče, na primjer, otopina kalijevog permanganata. Međutim, oksidacija u anhidrid maleinske kiseline može se izvesti pomoću katalizatora vanadijevog oksida:

- reakcija ozonolize. Također, benzen se podvrgava ozonolizi, ali je proces sporiji nego kod nezasićenih ugljovodonika:

Rezultat reakcije je stvaranje dialdehida - glioksala (1,2-etandijal).
- reakcija sagorevanja. Izgaranje benzena je granični slučaj oksidacije. Benzen je veoma zapaljiv i gori na vazduhu sa veoma zadimljenim plamenom:
Struktura
Po sastavu benzen spada u nezasićene ugljovodonike (homologne serije n 2n−6), ali za razliku od ugljovodonika serije etilena, 2 4 , on pokazuje svojstva svojstvena nezasićenim ugljovodonicima (odlikuju ih reakcije adicije), samo u teškim uslovima, ali je benzen skloniji reakcijama supstitucije. Ovo "ponašanje" benzena objašnjava se njegovom posebnom strukturom: prisustvom atoma u istoj ravni i prisustvom konjugovanog oblaka 6π-elektrona u strukturi. Moderna ideja o elektronskoj prirodi veza u benzenu zasniva se na hipotezi Linusa Paulinga, koji je predložio da se molekula benzena prikaže kao šestougao s upisanim krugom, čime se naglašava odsustvo fiksnih dvostrukih veza i prisutnost oblak jednog elektrona koji pokriva svih šest atoma ugljika u ciklusu.
U specijalizovanoj i popularnoj literaturi pojam benzenski prsten, koji se u pravilu odnosi na strukturu ugljika benzena bez uzimanja u obzir drugih atoma i grupa povezanih s atomima ugljika. Benzinski prsten je dio mnogih različitih spojeva.
Proizvodnja
Danas postoji nekoliko osnovnih razne načine proizvodnja benzena.

Aplikacija

Transport benzena željeznicom izvode se u specijalizovanim cisternama
Značajan dio dobivenog benzena koristi se za sintezu drugih proizvoda:
- oko 50% benzena se pretvara u etilbenzol (alkilacija benzena etilenom);
- oko 25% benzena se pretvara u kumen (alkilacija benzena sa propilenom);
- približno 10-15% benzena je hidrogenirano u cikloheksan;
- oko 10% benzena se troši na proizvodnju nitrobenzola;
- 2-3% benzena se pretvara u linearne alkilbenzene;
- otprilike 1% benzena se koristi za sintezu hlorobenzola.
U znatno manjim količinama benzen se koristi za sintezu nekih drugih jedinjenja. Povremeno i u ekstremnim slučajevima, zbog svoje visoke toksičnosti, benzen se koristi kao otapalo.
Osim toga, benzen je dio benzina. Tokom 1920-ih i 1930-ih, benzen je dodat rude u benzin za ravnu vožnju kako bi se povećao njegov oktanski broj, ali do 1940-ih takve mješavine nisu mogle konkurirati visokooktanskim benzinima. Zbog visoke toksičnosti, sadržaj benzena u gorivu je ograničen savremenim standardima na unošenje do 1%.
Biološko djelovanje i toksikologija
Benzen je jedan od najčešćih antropogenih ksenobiotika.
Benzen je veoma toksičan. Minimalna smrtonosna doza za oralnu primjenu je 15 ml, prosječna 50-70 ml. Kratkim udisanjem benzenske pare ne dolazi do trenutnog trovanja, pa do nedavno postupak rada s benzenom nije bio posebno reguliran. U velikim dozama benzen izaziva mučninu i vrtoglavicu, au nekim teškim slučajevima trovanje može biti smrtonosno. Prvi znak trovanja benzenom često je euforija. Pare benzena mogu prodrijeti u netaknutu kožu. Tečni benzol je prilično iritantan za kožu. Ako je ljudsko tijelo izloženo dugotrajnoj izloženosti benzenu u malim količinama, posljedice mogu biti i vrlo ozbiljne.
Benzen je jak kancerogen. Studije pokazuju povezanost benzena s bolestima kao što su aplastična anemija, akutna leukemija (mijeloična, limfoblastna), kronična mijeloična leukemija, mijelodisplastični sindrom i bolesti koštane srži.
Mehanizam transformacije i mutageno dejstvo benzena
Postoji nekoliko varijanti mehanizma transformacije benzena u ljudskom tijelu. U prvoj varijanti, molekul benzena se hidroksilira mikrozomalnim oksidacionim sistemom uz učešće citokroma P450. Prema mehanizmu, benzen se prvo oksidira u visoko reaktivni epoksid, koji se dalje pretvara u fenol. Osim toga, slobodni radikali (reaktivne vrste kisika) nastaju zbog visoke aktivacije P450 prema reakciji:
Molekularni mehanizam mutageneze benzena
Benzen je promutagen, mutagena svojstva stječe tek nakon biotransformacije, uslijed čega nastaju visoko reaktivna jedinjenja. Jedan od njih je benzen epoksid. Zbog visokog kutnog naprezanja epoksidnog ciklusa, -C-O-C- veze pucaju i molekula postaje elektrofil, lako reagira s nukleofilnim centrima dušičnih baza molekula nukleinske kiseline posebno DNK.
Mehanizam interakcije epoksi ciklusa sa nukleofilnim centrima - amino grupama azotnih baza (reakcija arilacije) odvija se kao reakcija nukleofilne supstitucije 2 . Kao rezultat, formiraju se prilično jaki kovalentno vezani adukti DNK; takvi derivati se najčešće uočavaju u gvaninu (jer molekula gvanina ima maksimalni iznos nukleofilni centri), na primjer, N7-fenilguanin. Rezultirajući adukti DNK mogu dovesti do promjene u nativnoj strukturi DNK, čime se poremeti pravilan tok transkripcije i replikacije. Šta je izvor genetskih mutacija. Akumulacija epoksida u hepatocitima (ćelijama jetre) dovodi do ireverzibilnih posljedica: povećanja arilacije DNK, a istovremeno i povećanja ekspresije (prekomjerne ekspresije) mutantnih proteina koji su produkti genetske mutacije; inhibicija apoptoze; transformaciju ćelije pa čak i smrt. Pored izražene izražene genotoksičnosti i mutagenosti, benzen ima jaku mijelotoksičnost i kancerogenu aktivnost, a posebno se to dejstvo manifestuje u ćelijama mijeloidnog tkiva (ćelije ovog tkiva su veoma osetljive na ovakva dejstva ksenobiotika).
Zloupotreba benzena i supstanci
Benzen ima zapanjujući učinak na osobu i može dovesti do ovisnosti o drogama.
Akutno trovanje
Pri vrlo visokim koncentracijama - gotovo trenutni gubitak svijesti i smrt u roku od nekoliko minuta. Boja lica je cijanotična, sluznice su često trešnje crvene. U nižim koncentracijama - ekscitacija, slična alkoholu, zatim pospanost, opšta slabost, vrtoglavica, mučnina, povraćanje, glavobolja, gubitak svijesti. Zapažaju se i trzaji mišića, koji se mogu pretvoriti u tonične konvulzije. Zenice su često proširene i ne reaguju na svetlost. Disanje se prvo ubrzava, a zatim usporava. Temperatura tijela naglo pada. Puls ubrzan, malog punjenja. Krvni pritisak je snižen. Zabilježeni su slučajevi teških srčanih aritmija.
Nakon teškog trovanja koje ne dovodi direktno do smrti, ponekad se uočavaju dugotrajni zdravstveni poremećaji: pleuritis, katari gornjih dišnih puteva, bolesti rožnice i mrežnice, oštećenje jetre, srčani poremećaji itd. Slučaj vazomotorike neuroze s oticanjem lica i ekstremiteta, poremećajima osjetljivosti i konvulzijama ubrzo nakon akutnog trovanja benzenom. Ponekad smrt nastupi neko vrijeme nakon trovanja.
hronično trovanje
U težim slučajevima javljaju se: glavobolja, izraziti umor, otežano disanje, vrtoglavica, slabost, nervoza, pospanost ili nesanica, probavne smetnje, mučnina, ponekad povraćanje, nedostatak apetita, pojačano mokrenje, menstruacija, uporno krvarenje iz oralne sluznice, posebno desni, često se razvija, i nos, koji traje satima, pa čak i danima. Ponekad se nakon vađenja zuba javlja uporno krvarenje. Brojna mala krvarenja (hemoragije) u koži. Krv u stolici, krvarenje iz materice, krvarenje u mrežnjači. Obično je krvarenje, a često i prateća groznica (temperatura do 40° i više) ono što otrovanog dovodi u bolnicu. U takvim slučajevima, prognoza je uvijek ozbiljna. Uzrok smrti ponekad su sekundarne infekcije: postoje slučajevi gangrenozne upale periosta i nekroze vilice, teške ulcerativne upale desni, opće sepse sa septičkim endometritisom.
Ponekad se kod teškog trovanja razvijaju simptomi nervnih bolesti: povećanje tetivnih refleksa, bilateralni klonus, pozitivan simptom Babinskog, poremećaj duboke osjetljivosti, pseudotabetički poremećaji s parestezijom, ataksijom, paraplegijom i motoričkim poremećajima (znakovi oštećenja stražnji stubovi kičmene moždine i piramidalni trakt).
Najtipičnije promjene u krvi. Broj eritrocita je obično naglo smanjen, na 1-2 miliona i manje. Sadržaj hemoglobina također naglo opada, ponekad i do 10%. Indeks boje u nekim slučajevima je nizak, ponekad blizu normalnog, a ponekad visok (posebno kod teške anemije). Primjećuje se anizocitoza i poikilocitoza, bazofilna punkcija i pojava nuklearnih eritrocita, povećanje broja retikulocita i volumena eritrocita. Tipičnije je oštro smanjenje broja leukocita. Ponekad u početku leukocitoza, brzo zamijenjena leukopenijom, ubrzanjem ESR. Promjene u krvi se ne razvijaju istovremeno. Najčešće je leukopoetski sistem zahvaćen ranije, kasnije se pridruži trombocitopenija. Poraz eritroblastične funkcije često se javlja i kasnije. U budućnosti se može razviti karakteristična slika teškog trovanja - aplastična anemija.
Efekti trovanja mogu potrajati, pa čak i napredovati mjesecima i godinama nakon prestanka rada s benzenom.
Prva pomoć kod trovanja i liječenje
U slučaju akutnog trovanja benzenom (benzenskim parama) žrtvu se prvo treba izvesti na svježi zrak, u slučaju zastoja disanja vrši se vještačko disanje do normalizacije, kisik i lobelin se koriste kao respiratorni stimulansi. Upotreba adrenalina kao analeptika je strogo zabranjena! Ako dođe do povraćanja, intravenozno 40% rastvor glukoze, u slučaju poremećaja cirkulacije - injekcija rastvora kofeina. Ako je do trovanja došlo oralno i benzen je dospio u želudac, potrebno ga je isprati biljnim uljem (benzen se dobro upija), postupak treba provoditi oprezno, jer je moguća aspiracija. Kod blagog trovanja, pacijentu se pokazuje mirovanje. U uzbuđenim stanjima potrebni su sedativi. U slučaju anemije rade se transfuzije krvi, vitamina B12, folne kiseline, kod leukopenije - vitamin B6, pentoksil. U slučaju smanjenja imuniteta (stanje imunodeficijencije) - imunostimulansi.
Djelovanje benzena na biomembrane
Biološke membrane su supramolekularne strukture - dvostruki lipidni sloj, u koji su integrirani (ugrađeni) ili pričvršćeni na površini molekula proteina, polisaharida. Lipidi koji čine biomembrane su po svojoj prirodi amfifilni (amofilni) spojevi, odnosno sposobni da se rastvaraju i u polarnim i u nepolarnim supstancama, zbog prisustva polarnih grupa u njima, tzv. "glava"(karboksilne -COOH, hidroksilne -OH, amino grupe -NH 2 i druge) i nepolarne tzv. "repovi"(ugljikovodični radikali - alkili, arili, policiklične strukture kao što je holestan i druge).
Benzen je efikasan solubilizator bioloških membrana, brzo otapa nepolarne grupe (tzv. "repovi") lipidi, uglavnom kolesterol, koji je dio membrana. Proces solubilizacije ograničen je koncentracijom benzena, što je više, to se proces brže odvija. U procesu solubilizacije oslobađa se energija koja doslovno razbija dvostruki lipidni sloj (lipidni dvosloj), što dovodi do potpunog uništenja (razaranja strukture) membrane i naknadne apoptoze ćelije (prilikom razaranja biomembrana aktiviraju se membranski receptori (npr. kao: CD95, TNFR1, DR3, DR4 i drugi) koji aktiviraju ćelijsku apoptozu).
Djelovanje na kožu
Kod čestog kontakta ruku sa benzenom, uočavaju se suva koža, pukotine, svrab, crvenilo (obično između prstiju), otok, mehurasti osip nalik prosu. Ponekad su, zbog oštećenja kože, radnici primorani da napuste posao.
Maksimalna dozvoljena koncentracija je 5 mg/m 3 .
Sigurnost
Rad sa benzenom nosi rizik od trovanja i ozbiljnih zdravstvenih problema. Benzen je vrlo isparljiva tečnost (isparljivost 320 mg/l na 20°C) sa visok stepen paljenja, stoga je pri radu s njim potrebno pridržavati se sigurnosnih mjera opreza za rad sa zapaljivim tekućinama. Pare benzena predstavljaju veliku opasnost, jer mogu stvoriti eksplozivne smjese sa zrakom. Trenutno je upotreba benzena kao organskog rastvarača ozbiljno ograničena zbog toksičnosti i kancerogenih učinaka njegovih para i negativnih učinaka na kožu. Rad s benzenom u laboratorijama također predviđa njegovo ograničenje (strogo regulirano). Benzen se preporučuje da se u eksperimentima koristi samo u malim količinama (ne više od 50 ml), rad treba obavljati isključivo u rukavicama od fluoro gume (lateks se otapa i bubri kada je izložen benzenu).
- skladištiti u blizini izvora toplote, otvorenog plamena, jaki oksidansi, prehrambeni proizvodi i tako dalje,
- ostaviti otvorene kontejnere koji sadrže benzol, dim,
- koristiti posude za benzen za upotrebu u hrani, pranje ruku, posuđa,
- rad u zatvorenoj, slabo provetrenoj prostoriji sa temperaturom vazduha većom od 30°C,
- koristiti veliku količinu supstance kao rastvarača,
- rad bez zaštitne opreme za kožu ruku, očiju i disajnih organa.
Ekologija
Benzen je ekološki nebezbedna supstanca, toksikant antropogenog porekla. Glavni izvori benzena koji ulaze u okruženje co kanalizacija ili emisije u zrak su petrohemijska i koksna industrija, proizvodnja goriva i transport. Iz rezervoara, benzen se lako ispari, sposoban je da se transformiše iz tla u biljke, što predstavlja ozbiljnu prijetnju ekosistemima.
Benzen ima svojstvo kumulacije, zbog svoje lipofilnosti, može se taložiti u ćelijama masnog tkiva životinja, čime ih truje.
PRTSVSH (F) FGBOU VPO
Odsjek "Protivpožarna sigurnost"
Test
u disciplini "Teorija sagorevanja i eksplozije"
Zadatak broj 1
Odredite specifične teorijske količine i zapreminu vazduha potrebne za potpuno sagorevanje pare benzena. Uslove u kojima se nalazi vazduh karakterišu temperatura Tv i pritisak Pv, a para benzena - temperatura Tg i pritisak Pg. Rezultate proračuna izraziti u sljedećim jedinicama: ; ;;;
Početni podaci (N - broj grupe, n - broj prema spisku učenika:
TV=300+(-1) N *2*N-(-1) n *0.2*n= 277.6 K
Pv = 10 3 = 95900 Pa;
Tg=300?(?1) N?2?N?(?1) n?0.2?n= 321.6 K;
Pr \u003d?10 3 \u003d 79400 Pa.
S6N6+7.5O2+7.5?3.76N2=6CO2+3pO+7.5?3.76N2+Qp (1),
gdje je Qp toplina kemijske reakcije. Od zadata jednačina moguće je odrediti stehiometrijske koeficijente benzena i molekulskog kiseonika: Vg = 1, V0 = 7,5
2. Specifična teorijska količina vazduha - broj kilomola vazduha koji je potreban za potpuno sagorevanje jednog kilomola benzena izračunava se po formuli:
gdje je 4,76 količina zraka koja sadrži jedinicu kisika, \u003d je omjer stehiometrijskih koeficijenata molekularnog kisika (Vo) i benzena (Vg)
Zamjenom u (d) vrijednostima Vo i Vg dobijamo:
3. Zapremina zraka potrebna za potpuno sagorijevanje jednog kilomola benzena određuje se na sljedeći način:
gdje je zapremina jednog kilomola zraka na temperaturi Tv i pritisku Pv. Vrijednost se izračunava pomoću formule
gde je 22,4 molarni volumen gasa u normalnim uslovima, Po = 101325 Pa je normalan pritisak, To = 273 K je normalna temperatura.
Zamjenom Tv, To, Pv, Po u (5), dobijamo
Specifična teoretska zapremina vazduha izračunava se po formuli (4):
4. Količina vazduha potrebna za potpuno sagorevanje jedinične zapremine gasovitog goriva određuje se na sledeći način:
gdje je zapremina jednog kilomola goriva - benzenske pare na temperaturi Tg i pritisku Pg. S obzirom na to
i zamjenom (8) i (5) u (7) dobijamo sljedeći izraz za specifičnu teorijsku zapreminu zraka:
Izračunavamo vrijednost ovog parametra procesa sagorijevanja:
Zapremina zraka potrebna za potpuno sagorijevanje jednog kilograma benzena određuje se na sljedeći način:
gdje - molarna masa goriva je masa jednog kilomola benzena, izražena u kilogramima. Molarna masa benzena numerički je jednaka njegovoj molekulskoj težini nalazi se po formuli:
Ac?nc + An?nn, UiAi?ni (11)
gdje su Ac i An atomske težine ugljika i vodonika, nc i nn su brojevi atoma ugljika u molekulu benzena. Zamjenom vrijednosti Ac = 12, nc = 6, An = 1, nn = 6, dobijamo:
Specifičnu teoretsku zapreminu zraka nalazimo zamjenom vrijednosti n u i u formulu (10):
Rezultat izračuna:
Zadatak broj 2
Odrediti specifičnu teorijsku količinu, zapreminu i sastav produkata sagorevanja benzena, ako su poznati koeficijent viška vazduha c, temperatura Tp i pritisak Pp produkata sagorevanja, temperatura Tg i pritisak Pg para benzena. Rezultate proračuna izraziti u molnim udjelima (u procentima) iu sljedećim jedinicama: ; ;;
Početni podaci:
c=1,5+(?1) N?0,1?N?(?1) n?0,01?n = 0,2;
Rp = 10 3 = 68400 Pa;
Tp=1600?(?1) N?20?N?(?1) n?2?n = 1816 K;
Tg=273?(?1) N?2?N+(?1) n?0.2?n = 295.4 K;
Rg = 10 3 = 111600 Pa;
rješenje (N=11, n=2).
1. Zapisujemo stehiometrijsku jednačinu za reakciju sagorijevanja benzena na zraku:
C 6 H 6 +7,5O 2 +7,5? 3,76N 2 = 6CO 2 + 3H 2 O + 7,5? 3,76N 2 + Qp, (1)
gdje je Qp toplina kemijske reakcije. Iz ove jednačine određujemo sljedeće stehiometrijske koeficijente:
V CO2 = 6, V pO = 3, V C6H6 = 1, V O2 = 7,5, V N2 = 7,5? 3,76
2. Odrediti procijenjenu količinu produkata sagorijevanja jednog kilomola goriva:
Zamjenom u (2) vrijednostima stehiometrijskih koeficijenata produkata sagorijevanja i goriva dobijamo:
3. Specifičnu teorijsku količinu zraka - broj kilomola zraka koji je potreban za potpuno sagorijevanje jednog kilomola goriva određujemo pomoću formule:
gdje je 4,76 količina zraka koja sadrži jedinicu kisika,
Odnos stehiometrijskih koeficijenata molekulskog kiseonika i benzena.
Zamjenom u (4) vrijednosti V O2 =7,5 i V C6H6 =1 dobijamo:
4. Višak zraka koji padne na 1 Kmol goriva određuje se izrazom:
benzen parni vazduh za sagorevanje
Zamjena vrijednosti u ovom izrazu
37,7(0,2-1)=30,16(7)
5. Ukupna količina produkata sagorevanja po jedinici količine gorivne materije određena je zbrojem:
Nakon zamjene vrijednosti dobijamo:
6. Molni udjeli proizvoda sagorijevanja, izraženi u postocima, određuju se na sljedeći način:
U formulama (9) za molske udjele dušika i kisika u produktima sagorijevanja, 0,79 i 0,21 su molni udjeli ovih tvari u zraku, čiji višak dovodi do povećanja udjela dušika i pojave kisika. u produktima sagorevanja.
7. Da bi se odredile specifične zapremine i produkti sagorevanja, potrebno je izračunati njihovu molarnu zapreminu - zapreminu jednog kilomola gasa pod uslovima u kojima se proizvodi nalaze:
gdje je 22,4 volumen jednog kilomola plina u normalnim uvjetima, T 0 = 273K - normalna temperatura, Po = 101325 Pa - normalni tlak.
Zamjenom u (10) vrijednosti, Po, To, dobijamo:
Volumen proizvoda koji nastaju prilikom sagorijevanja jednog kilograma goriva, isključujući višak zraka, izračunava se na sljedeći način:
gdje - molarna masa goriva je masa jednog kilomola benzena, izražena u kilogramima. Molarna masa benzena se nalazi po formuli:
gdje su Ac i An atomske težine ugljika (12) i vodika (1), n c i n n su brojevi atoma ugljika (6) i vodika (6) u molekulima benzena (C 6 H 6).
Zamjenom vrijednosti u (12) dobijamo
Višak volumena zraka po 1 kilogramu goriva određuje se na sljedeći način:
gdje je zapremina jednog kilomola viška zraka, koji je dio produkata izgaranja. Budući da temperatura i pritisak viška zraka odgovaraju temperaturi i pritisku produkata izgaranja, tada \u003d \u003d 220,7.
Zamjenom ove vrijednosti, kao i u (14), dobijamo:
Da bismo izračunali specifičnu zapreminu proizvoda potpunog sagorevanja goriva, pretpostavljamo da para benzena ima temperaturu Tg pri pritisku:
gdje je zapremina jednog kilomola pare benzena na temperaturi Tg i pritisku Pg. Molarni volumen goriva izračunava se po formuli:
Zamjenom dobijene vrijednosti i takvih vrijednosti u (17) dobijamo:
Višak vazduha po jednom kubni metar para benzena, definirana je kako slijedi:
Zamjena u (20) vrijednosti \u003d 30,16 , \u003d i
daje sljedeći rezultat:
Ukupna specifična zapremina produkata sagorevanja, uzimajući u obzir višak vazduha, određena je zbrojem
Rezultat izračuna:
X CO2 \u003d%; X H2O \u003d 4,4%; X N2 =%; X O2 = 11,7%
Slični dokumenti
Proračun koeficijenta zapaljivosti nitrobenzena C6H5NO2 i ugljičnog disulfida CS2. Jednačina za reakciju sagorijevanja propil acetata na zraku. Proračun zapremine vazduha i produkata sagorevanja pri sagorevanju zapaljivog gasa. Određivanje tačke paljenja toluena prema formuli V. Blinova.
test, dodato 08.04.2017
Proračun zapremine vazduha i produkata sagorevanja nastalih tokom sagorevanja neke supstance. Jednačina za reakciju sagorijevanja etilen glikola na zraku. Sagorevanje mešavine zapaljivih gasova. Proračun adijabatske temperature izgaranja za stehiometrijsku smjesu. sagorevanje propanola.
test, dodano 17.10.2012
Vrsta izgaranja i njegovi glavni parametri. Hemijska konverzija goriva i oksidansa u produkte sagorijevanja. Jednačine materijalnog i toplotnog bilansa reakcije sagorevanja. Utjecaj koeficijenta viška zraka na sastav produkata izgaranja i temperaturu sagorijevanja.
test, dodano 17.01.2013
Određivanje zapremine vazduha potrebnog za potpuno sagorevanje jedinice mase zapaljive supstance. Sastav proizvoda sagorevanja jedinice mase zapaljive supstance. Granice širenja plamena mješavine plina, pare, prašine i zraka. Eksplozivni pritisak raspadanja.
seminarski rad, dodan 23.12.2013
Izrada mjera za sprječavanje nastanka požara i eksplozija, procjena uslova za njihov razvoj i suzbijanje. Pojam stope izgaranja, način njegovog definiranja. Postupak sastavljanja jednadžbe reakcije sagorijevanja. Proračun količine vazduha potrebnog za paljenje.
seminarski rad, dodan 10.07.2014
Određivanje sastava proizvoda potpunog sagorevanja gasa. Proračun adijabatske temperature sagorevanja gasne mešavine pri konstantnoj zapremini i konstantnom pritisku. Kinetičke reakcijske konstante samozapaljenja prirodnog plina. Granica paljenja gasne mešavine.
seminarski rad, dodan 19.02.2014
Karakterizacija industrijskih metoda za alkilaciju benzena propilenom. Principi alkilacije benzena olefinima u hemijskoj tehnologiji. Problemi projektovanja tehnoloških instalacija za alkilaciju benzena. Opis tehnologije proizvodnog procesa.
teza, dodana 15.11.2010
Sagorijevanje je snažan proces oksidacije. Vrste izgaranja: tinjanje i gorenje plamenom. Eksplozija kao poseban slučaj sagorevanja. Električna svojstva plamena. Raznolikost proizvoda sagorevanja kao rezultat nepotpunog sagorevanja goriva. Filtracija dima kroz vodu.
naučni rad, dodato 29.07.2009
Određivanje zapremine vazduha potrebnog za potpuno sagorevanje date količine propana. Proračun promjene entalpije, entropije i Gibbsove energije, koristeći posljedice Hessovog zakona. Određivanje ekvivalenata molarne mase oksidacionog agensa i redukcionog sredstva.
test, dodano 08.02.2012
Metode za određivanje potrošnje upijajućeg ulja, koncentracije benzena u upijajućem ulju koje izlazi iz apsorbera. Proračun prečnika i visine nabijenog apsorbera. Određivanje potrebne ogrjevne površine u kocki stuba i utroška grijaće pare.
Predstavljamo vašoj pažnji video tutorijal na temu " Hemijska svojstva Benzen". Koristeći ovaj video, možete dobiti ideju o hemijskim svojstvima benzena, kao i o teškim uslovima koji su potrebni da benzen reaguje sa drugim supstancama.
Tema:aromatični ugljovodonici
lekcija:Hemijska svojstva benzena
Rice. 1. Molekul benzena
Razbijanje oblaka p-elektrona u molekulu benzena je teško. Stoga benzen ulazi u kemijske reakcije mnogo manje aktivno od nezasićenih spojeva.


Da bi benzen ušao u kemijske reakcije, potrebni su prilično teški uvjeti: povišena temperatura, au mnogim slučajevima i katalizator. U većini reakcija, stabilni benzenski prsten se zadržava.
1. Bromiranje.

Potreban je katalizator (gvožđe(III) ili aluminijum bromid) i ne sme se dozvoliti da uđe čak i male količine vode. Uloga katalizatora je da molekul broma privlači jedan od atoma broma na atom željeza. Kao rezultat toga, polarizira se - par elektrona veze prelazi na atom broma povezan s željezom:
Br+…. Br - FeBr 3 .
Br+ je jak elektrofil. Privlači ga oblak od šest elektrona benzenskog prstena i razbija ga, formirajući ga kovalentna veza sa atomom ugljika:
Anion broma mogao bi se pridružiti rezultirajućem kationu. Ali redukcija aromatičnog sistema benzenskog prstena energetski je povoljnija od dodavanja brom anjona. Stoga molekul prelazi u stabilno stanje izbacivanjem vodikovog jona:
Sve reakcije elektrofilne supstitucije u benzenskom prstenu odvijaju se po sličnom mehanizmu.
2. Nitracija

Benzen i njegovi homolozi reagiraju sa mješavinom koncentrisane sumporne i dušične kiseline (smjesa za nitraciju). U nitrirajućoj smeši, u ravnoteži, nalazi se nitronijum ion NO 2+, koji je elektrofil:

3. Sulfoniranje.
Benzen i drugi areni, kada se zagriju, reagiraju s koncentriranom sumpornom kiselinom ili oleumom - otopinom SO 3 u sumpornoj kiselini:

4 . Friedel-Crafts Alkylation
5. Alkilacija sa alkenima

Ove reakcije su energetski nepovoljne, pa se odvijaju samo kada se zagreju ili zrače.
1. Hidrogenacija.
Kada se zagreju, pod povišenim pritiskom i u prisustvu Ni, Pt ili Pd katalizatora, benzen i drugi areni dodaju vodonik da bi se formirao cikloheksan:

2. Kloriranje benzena.
Pod dejstvom ultraljubičastog zračenja, benzen dodaje hlor. Ako se tikvica od kvarcnog stakla sa rastvorom hlora u benzenu izloži sunčevoj svetlosti, rastvor će brzo promeniti boju, hlor će se spojiti sa benzenom i formirati 1,2,3,4,5,6-heksahlorcikloheksan, koji je poznat kao heksahloran(ranije korišten kao insekticid):

3. sagorevanje benzena.
Za razliku od alkana, plamen benzena i drugih aromatičnih ugljovodonika je svetao i zadimljen.
Sumiranje lekcije
U ovoj lekciji ste proučavali temu "Kemijska svojstva benzena". Koristeći ovaj materijal, stekli ste ideju o hemijskim svojstvima benzola, kao io teškim uslovima koji su potrebni da benzen reaguje sa drugim supstancama.
Bibliografija
1. Rudžitis G.E. hemija. Osnove opšta hemija. 10. razred: udžbenik za obrazovne institucije: osnovni nivo / G. E. Rudzitis, F.G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012.
2. Hemija. 10. razred. Nivo profila: udžbenik. za opšte obrazovanje institucije / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i drugi - M.: Drofa, 2008. - 463 str.
3. Hemija. 11. razred. Nivo profila: udžbenik. za opšte obrazovanje institucije / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin i drugi - M.: Drofa, 2010. - 462 str.
4. Khomchenko G.P., Khomchenko I.G. Zbirka zadataka iz hemije za one koji upisuju fakultete. - 4. izd. - M.: RIA "Novi talas": Izdavač Umerenkov, 2012. - 278 str.
Zadaća
1. br. 13, 14 (str. 62) Rudžitis G.E., Feldman F.G. hemija: Organska hemija. 10. razred: udžbenik za obrazovne ustanove: osnovni nivo / G. E. Rudzitis, F.G. Feldman. - 14. izdanje. - M.: Obrazovanje, 2012.
2. Zašto se aromatična jedinjenja razlikuju po hemijskim svojstvima i od zasićenih i od nezasićenih ugljovodonika?
3. Napišite jednadžbe za reakcije sagorijevanja etilbenzola i ksilena.
DEFINICIJA
Benzen(cikloheksatrien - 1,3,5) - organska materija, najjednostavniji predstavnik niza aromatičnih ugljovodonika.
Formula - C 6 H 6 (strukturna formula - sl. 1). Molekularna masa – 78, 11.
Rice. 1. Strukturne i prostorne formule benzena.
Svih šest atoma ugljika u molekuli benzena su u sp 2 hibridnom stanju. Svaki atom ugljika formira 3σ veze s dva druga atoma ugljika i jednim atomom vodika koji leže u istoj ravni. Šest atoma ugljika formira pravilan šesterokut (σ-skelet molekula benzena). Svaki atom ugljika ima jednu nehibridiziranu p-orbitalu, koja sadrži jedan elektron. Šest p-elektrona formiraju jedan oblak π-elektrona (aromatski sistem), koji je prikazan kao krug unutar šestočlanog ciklusa. Ugljovodonični radikal izveden iz benzena naziva se C 6 H 5 - - fenil (Ph-).
Hemijska svojstva benzena
Benzen karakteriziraju supstitucijske reakcije koje se odvijaju prema elektrofilnom mehanizmu:
- halogeniranje (benzen stupa u interakciju sa hlorom i bromom u prisustvu katalizatora - bezvodni AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- nitriranje (benzen lako reaguje sa nitrirajućom mešavinom - mešavinom koncentrovane azotne i sumporne kiseline)

- alkilacija sa alkenima
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Reakcije adicije na benzen dovode do uništenja aromatičnog sistema i odvijaju se samo u teškim uslovima:
- hidrogenacija (reakcija teče kada se zagrije, katalizator je Pt)

- dodavanje hlora (nastaje pod dejstvom UV zračenja sa stvaranjem čvrstog proizvoda - heksahlorocikloheksan (heksahloran) - C 6 H 6 Cl 6)

Kao i svaki organsko jedinjenje benzen ulazi u reakciju sagorijevanja s formiranjem kao produkti reakcije ugljen-dioksid i vode (gori dimljenim plamenom):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
Fizička svojstva benzena
Benzen je bezbojna tečnost, ali ima specifičan oštar miris. Formira azeotropnu smjesu s vodom, dobro se miješa sa eterima, benzinom i raznim organskim rastvaračima. Tačka ključanja - 80,1C, tačka topljenja - 5,5C. Toksičan, kancerogen (tj. doprinosi razvoju raka).
Dobijanje i upotreba benzena
Glavne metode za dobijanje benzena:
— dehidrociklizacija heksana (katalizatori - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
- dehidrogenacija cikloheksana (reakcija teče kada se zagrije, katalizator je Pt)
C 6 H 12 → C 6 H 6 + 4H 2;
– trimerizacija acetilena (reakcija teče kada se zagrije na 600C, katalizator je aktivni ugljen)
3HC≡CH → C 6 H 6 .
Benzen služi kao sirovina za proizvodnju homologa (etilbenzol, kumen), cikloheksana, nitrobenzola, hlorobenzena i drugih supstanci. Ranije se benzen koristio kao aditiv benzinu za povećanje njegovog oktanskog broja, međutim, sada je zbog njegove visoke toksičnosti sadržaj benzena u gorivu strogo reguliran. Ponekad se benzol koristi kao rastvarač.
Primjeri rješavanja problema
PRIMJER 1
| Zadatak | Zapišite jednačine pomoću kojih možete izvršiti sljedeće transformacije: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Rješenje | Za dobivanje acetilena iz metana koristi se sljedeća reakcija: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). Dobivanje benzena iz acetilena moguće je reakcijom trimerizacije acetilena, koja se javlja pri zagrijavanju (t = 600C) iu prisustvu aktivnog ugljena: 3C 2 H 2 → C 6 H 6 . Reakcija hloriranja benzena da bi se dobio hlorobenzen kao produkt provodi se u prisustvu željeznog (III) hlorida: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
PRIMJER 2
| Zadatak | U 39 g benzena u prisustvu gvožđe (III) hlorida dodat je 1 mol bromne vode. Koju količinu supstance i koliko grama kojih proizvoda je to rezultiralo? |
| Rješenje | Napišimo jednačinu za reakciju bromiranja benzena u prisustvu željezovog (III) hlorida: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Produkti reakcije su bromobenzen i bromovodonik. Molarna masa benzena, izračunata pomoću tabele hemijski elementi DI. Mendeljejev - 78 g/mol. Pronađite količinu benzola: n(C 6 H 6) = m(C 6 H 6) / M(C 6 H 6); n(C 6 H 6) = 39/78 = 0,5 mol. U skladu sa uslovom zadatka, benzen je reagovao sa 1 molom broma. Shodno tome, benzena nedostaje i za benzen će se vršiti dalji proračuni. Prema jednadžbi reakcije n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) = 1: 1: 1, dakle n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n(HBr) = 0,5 mol. Tada će mase bromobenzena i bromovodonika biti jednake: m(C 6 H 5 Br) = n(C 6 H 5 Br)×M(C 6 H 5 Br); m(HBr) = n(HBr)×M(HBr). Molarne mase bromobenzena i bromovodonika, izračunate pomoću tabele hemijskih elemenata D.I. Mendeljejev - 157 i 81 g/mol, respektivno. m(C 6 H 5 Br) = 0,5×157 = 78,5 g; m(HBr) = 0,5 x 81 = 40,5 g. |
| Odgovori | Produkti reakcije su bromobenzen i bromovodonik. Mase bromobenzena i bromovodonika su 78,5 i 40,5 g, respektivno. |
Prva grupa reakcija su supstitucijske reakcije. Rekli smo da areni nemaju višestruke veze u molekularnoj strukturi, već sadrže konjugovani sistem od šest elektrona, koji je veoma stabilan i daje dodatnu snagu benzenskom prstenu. Stoga, u hemijske reakcije prvo dolazi do zamjene atoma vodika, a ne do razaranja benzenskog prstena.
Već smo se susreli sa supstitucijskim reakcijama kada smo govorili o alkanima, ali za njih su te reakcije tekle po radikalnom mehanizmu, a za arene je karakterističan ionski mehanizam supstitucijskih reakcija.
Prvo hemijsko svojstvo - halogeniranje. Zamjena atoma vodika za atom halogena - klora ili broma.
Reakcija se odvija pri zagrijavanju i uvijek uz učešće katalizatora. U slučaju hlora, to može biti aluminijum hlorid ili željezo hlorid tri. Katalizator polarizuje molekulu halogena, što dovodi do kidanja heterolitičke veze i dobijanja jona.
Pozitivno nabijeni hloridni ion reagira s benzenom.
Ako se reakcija dogodi s bromom, tada željezni tribromid ili aluminij bromid djeluje kao katalizator.

Važno je napomenuti da se reakcija odvija s molekularnim bromom, a ne s bromnom vodom. Benzen ne reaguje sa bromnom vodom.
Halogenacija homologa benzena ima svoje karakteristike. U molekulu toluena, metilna grupa olakšava supstituciju u prstenu, reaktivnost se povećava, a reakcija se odvija u blažim uslovima, odnosno već na sobnoj temperaturi.

Važno je napomenuti da se supstitucija uvijek događa u orto i para pozicijama, tako da se dobije mješavina izomera.
Sekunda svojstvo - nitracija benzena, uvođenje nitro grupe u benzenski prsten.

Nastaje teška žućkasta tečnost sa mirisom gorkog badema - nitrobenzol, pa reakcija može biti kvalitativna za benzen. Za nitriranje se koristi nitrirajuća mješavina koncentrirane dušične i sumporne kiseline. Reakcija se izvodi zagrijavanjem.
Da podsjetim da je za nitraciju alkana u Konovalovskoj reakciji korištena razrijeđena dušična kiselina bez dodatka sumporne kiseline.
Pri nitriranju toluena, kao i pri halogeniranju, nastaje mješavina orto- i para-izomera.

Treće svojstvo - alkilacija benzena sa haloalkanima.

Ova reakcija omogućava uvođenje ugljikovodičnih radikala u benzenski prsten i može se smatrati metodom za dobivanje homologa benzena. Aluminij hlorid se koristi kao katalizator, koji pospješuje razgradnju molekula haloalkana na ione. Također je potrebno grijanje.
Četvrto svojstvo - alkilacija benzena sa alkenima.

Na ovaj način se može dobiti, na primjer, kumen ili etilbenzol. Katalizator je aluminijum hlorid.
2. Reakcije dodavanja benzolu
Druga grupa reakcija su reakcije adicije. Rekli smo da ove reakcije nisu karakteristične, ali su moguće u prilično teškim uslovima uz uništavanje oblaka pi-elektrona i formiranje šest sigma veza.
Peto svojstvo u opštoj listi - hidrogenacija, dodavanje vodonika.
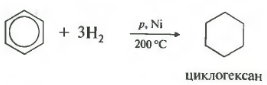
Temperatura, pritisak, katalizator nikl ili platina. Toluen može reagirati na isti način.
šesto svojstvo - hlorisanje. Napominjemo da govorimo konkretno o interakciji s hlorom, jer brom ne ulazi u ovu reakciju.

Reakcija se odvija pod jakim ultraljubičastim zračenjem. Heksahlorocikloheksan, drugo ime za heksahloran, nastaje, čvrsta supstanca.
Važno je to zapamtiti za benzen nemoguće reakcije adicije halogenovodonika (hidrohalogenacija) i dodavanja vode (hidratacija).
3. Zamjena u bočnom lancu homologa benzena
Treća grupa reakcija odnosi se samo na homologe benzena - ovo je supstitucija u bočnom lancu.
sedmi svojstvo u općoj listi je halogeniranje na alfa atomu ugljika u bočnom lancu.

Reakcija se događa kada se zagrije ili ozrači, i to uvijek samo na alfa ugljiku. Kako se halogenacija nastavlja, drugi atom halogena će se vratiti u alfa položaj.
4. Oksidacija homologa benzena
Četvrta grupa reakcija je oksidacija.
Benzinski prsten je prejak, pa benzen ne oksidira kalijum permanganat - ne mijenja boju svoje otopine. Ovo je veoma važno zapamtiti.
S druge strane, homolozi benzena se pri zagrijavanju oksidiraju zakiseljenom otopinom kalijevog permanganata. A ovo je osmo hemijsko svojstvo.

Ispada benzojeva kiselina. Primjećuje se promjena boje otopine. U ovom slučaju, bez obzira koliko je dugačak lanac ugljika supstituenta, on se uvijek prekida nakon prvog atoma ugljika i alfa atom se oksidira u karboksilnu grupu uz stvaranje benzojeve kiseline. Ostatak molekule se oksidira u odgovarajuću kiselinu ili, ako je samo jedan atom ugljika, u ugljični dioksid.
Ako homolog benzena ima više od jednog supstituenta ugljikovodika na aromatičnom prstenu, tada se oksidacija odvija po istim pravilima - ugljik u alfa položaju se oksidira.

U ovom primjeru dobija se dvobazna aromatična kiselina, koja se naziva ftalna kiselina.
Na poseban način ističem oksidaciju kumena, izopropilbenzena, atmosferskim kiseonikom u prisustvu sumporne kiseline.

Ovo je takozvana metoda kumena za proizvodnju fenola. Po pravilu se sa ovom reakcijom mora suočiti u pitanjima koja se odnose na proizvodnju fenola. Ovo je industrijski način.
deveto svojstvo - sagorijevanje, potpuna oksidacija kiseonik. Benzen i njegovi homolozi sagorevaju u ugljični dioksid i vodu.
Zapišimo jednačinu sagorijevanja benzena u opštem obliku.
Prema zakonu održanja mase, na lijevoj strani treba biti onoliko atoma koliko je atoma na desnoj strani. Jer, na kraju krajeva, u kemijskim reakcijama atomi ne idu nikuda, već se redoslijed veza između njih jednostavno mijenja. Dakle, biće onoliko molekula ugljičnog dioksida koliko ima atoma ugljika u molekulu arena, budući da molekula sadrži jedan atom ugljika. To je n CO 2 molekula. Molekula vode će biti upola manje od atoma vodonika, odnosno (2n-6) / 2, što znači n-3.
Isti je broj atoma kiseonika sa leve i desne strane. Desno je 2n iz ugljičnog dioksida, jer se u svakom molekulu nalaze dva atoma kisika, plus n-3 iz vode, ukupno 3n-3. Na lijevoj strani je isti broj atoma kisika - 3n-3, što znači da ima upola manje molekula, jer molekul sadrži dva atoma. To je (3n-3)/2 molekula kiseonika.
Dakle, sastavili smo jednačinu za sagorevanje homologa benzena u opštem obliku.