   |
|
| Szisztematikus Név | benzol |
| Rövidítések | PhH |
| Hagyományos nevek | hajszárító (Laurent, 1837), fenil-hidrogén, benzol |
| Chem. képlet | C₆H₆ |
| Állapot | folyékony |
| Moláris tömeg | 78,11 g/mol |
| Sűrűség | 0,8786 g/cm³ |
| Dinamikus viszkozitás | 0,0652 Pa s |
| Ionizációs energia | 9,24 ± 0,01 eV |
| T. olvad. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | -11° |
| T. svsp. | 562° |
| Stb. robbanás | 1,2 ± 0,1 térfogat% |
| Gőznyomás | 75 ± 1 Hgmm |
| vízben oldhatóság | 0,073 g/100 ml |
| GOST | GOST 5955-75 |
| Reg. CAS szám | 71-43-2 |
| PubChem | 241 |
| Reg. EINECS szám | 200-753-7 |
| MOSOLYOK | C1=CC=CC=C1 |
| InChI | |
| RTECS | 1400000 CY |
| CHEBI | 16716 |
| ChemSpider | 236 |
| Toxicitás | mérgező, rákkeltő és narkotikus tulajdonságokkal rendelkezik |
| jelző szó | VESZÉLYESEN! |
| Az adatok standard körülményekre vonatkoznak (25°, 100 kPa), hacsak nincs másképp jelezve. | |
Kémiai tulajdonságok
A szubsztitúciós reakciók jellemzőek a benzolra - a benzol reakcióba lép alkénekekkel, klór-alkánokkal, halogénekkel, salétrom- és kénsavval. A benzolgyűrű hasítási reakciói zord körülmények között (hőmérséklet, nyomás) játszódnak le.
- Az alkénekkel való kölcsönhatás (alkilezés), a reakció eredményeként benzolhomológok képződnek, például etil-benzol és kumol:
- Klórral és brómmal való kölcsönhatás katalizátor jelenlétében klór-benzol képzésére (elektrofil szubsztitúciós reakció):
- Katalizátor hiányában hexaklór-ciklohexán izomerek keveréke képződésével, hexaklór-ciklohexán izomerek keverékének képződésével, hexaklór-ciklohexán izomerek elegyének képződésével, hexaklór-ciklohexán-izomerek hozzáadásával járó reakciót hevítve vagy megvilágítva.
- Amikor a benzol óleumoldatban brómmal reagál, hexabróm-benzol képződik:
- Kölcsönhatás alkánok halogén származékaival (benzol alkilezés, Friedel-Crafts reakció) alkilbenzolok képzése érdekében:

- A benzol-anhidridek, karbonsav-halogenidek Friedel-Crafts acilezési reakciója aromás és zsíros aromás ketonok képződéséhez vezet:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
Az első és a második reakcióban acetofenon (metil-fenil-keton) képződik, az alumínium-klorid antimon-kloriddal történő helyettesítésével a reakcióhőmérséklet 25 °C-ra csökkenthető. A harmadik reakcióban benzofenon (difenil-keton) képződik.
- A formilezési reakció - a benzol kölcsönhatása CO és HCl keverékével, nagy nyomáson és katalizátor hatására a reakciótermék benzaldehid:
- Szulfonálási és nitrálási reakciók (elektrofil szubsztitúció):
- Benzol redukciója hidrogénnel (katalitikus hidrogénezés):
Oxidációs reakciók
A benzol szerkezetének köszönhetően nagyon ellenáll az oxidációnak, nem befolyásolja például a kálium-permanganát oldat. A maleinsavanhidriddé való oxidáció azonban végrehajtható vanádium-oxid katalizátor használatával:

- ozonolízis reakció. Ezenkívül a benzol ozonolízisen megy keresztül, de a folyamat lassabb, mint a telítetlen szénhidrogéneknél:

A reakció eredményeként dialdehid-glioxál (1,2-etándiál) képződik.
- égési reakció. A benzol égése az oxidáció korlátozó esete. A benzol nagyon gyúlékony és a levegőben nagyon füstös lánggal ég:
Szerkezet
Összetételük szerint a benzol a telítetlen szénhidrogénekhez tartozik (homológ sorozat n 2n−6), de az etilén sorozatú szénhidrogénektől eltérően, 2 4 csak zord körülmények között mutat a telítetlen szénhidrogénekben rejlő tulajdonságokat (addíciós reakciók jellemzik őket), de a benzol hajlamosabb a szubsztitúciós reakciókra. A benzolnak ezt a "viselkedését" a különleges szerkezete magyarázza: az atomok ugyanabban a síkban való jelenléte és a konjugált 6π-elektronfelhő jelenléte a szerkezetben. A benzolban lévő kötések elektronikus természetének modern elképzelése Linus Pauling hipotézisén alapul, aki azt javasolta, hogy a benzolmolekulát hatszögként ábrázolják egy beírt körrel, ezzel is hangsúlyozva a rögzített kettős kötések hiányát és a kettős kötés jelenlétét. egyetlen elektronfelhő, amely a ciklus mind a hat szénatomját lefedi.
A szak- és populáris irodalomban a kifejezés benzolgyűrű, amely általában a benzol szénszerkezetére utal anélkül, hogy figyelembe venné a szénatomokhoz kapcsolódó egyéb atomokat és csoportokat. A benzolgyűrű számos különböző vegyület része.
Termelés
Ma már több alapvető különböző módokon benzolgyártás.

Alkalmazás

A benzol szállítása vasúton speciális tartálykocsikban hajtják végre
A keletkező benzol jelentős részét más termékek szintézisére használják fel:
- a benzol körülbelül 50%-a etil-benzollá alakul (a benzol alkilezése etilénnel);
- a benzol körülbelül 25%-a kumolná alakul (a benzol alkilezése propilénnel);
- a benzol körülbelül 10-15%-át hidrogénezzük ciklohexánná;
- a benzol körülbelül 10%-át nitrobenzol előállítására fordítják;
- a benzol 2-3%-a lineáris alkilbenzolokká alakul;
- a benzol körülbelül 1%-át használják fel a klórbenzol szintéziséhez.
Sokkal kisebb mennyiségben a benzolt néhány más vegyület szintézisére használják. Alkalmanként és szélsőséges esetekben nagy toxicitása miatt benzolt használnak oldószerként.
Ezenkívül a benzol a benzin része. Az 1920-as és 1930-as években a benzolt ru de hozzáadták az egyenes lefúvatású benzinhez, hogy növeljék annak oktánszámát, de az 1940-es évekre az ilyen keverékek már nem tudtak versenyezni a magas oktánszámú benzinekkel. A magas toxicitás miatt az üzemanyag benzoltartalmát a modern szabványok legfeljebb 1%-ra korlátozzák.
Biológiai hatás és toxikológia
A benzol az egyik leggyakoribb antropogén xenobiotikum.
A benzol erősen mérgező. A minimális halálos dózis orális adagolás esetén 15 ml, az átlag 50-70 ml. A benzolgőz rövid belélegzése esetén nem következik be azonnali mérgezés, ezért egészen a közelmúltig a benzollal végzett munka eljárását nem szabályozták különösebben. Nagy adagokban a benzol hányingert és szédülést okoz, és egyes súlyos esetekben a mérgezés végzetes is lehet. A benzolmérgezés első jele gyakran az eufória. A benzolgőz áthatolhat az érintetlen bőrön. A folyékony benzol meglehetősen irritálja a bőrt. Ha az emberi szervezet kis mennyiségben hosszú távú benzolnak van kitéve, a következmények is nagyon súlyosak lehetnek.
A benzol erős rákkeltő anyag. Tanulmányok kimutatták a benzol összefüggését olyan betegségekkel, mint az aplasztikus anémia, akut leukémia (mieloid, limfoblaszt), krónikus mieloid leukémia, mielodiszplasztikus szindróma és csontvelő-betegségek.
A benzol átalakulási mechanizmusa és mutagén hatása
A benzol emberi szervezetben történő átalakulásának mechanizmusának számos változata létezik. Az első változatban a benzolmolekulát a mikroszomális oxidációs rendszer hidroxilezi citokróm P450 részvételével. A mechanizmus szerint a benzol először nagyon reaktív epoxiddá oxidálódik, amely tovább alakul fenollá. Ezenkívül szabad gyökök (reaktív oxigénfajták) keletkeznek a P450 magas aktiválódása miatt a reakció szerint:
A benzol mutagenezisének molekuláris mechanizmusa
A benzol az promutagén, csak biotranszformáció után tesz szert mutagén tulajdonságokra, melynek eredményeként erősen reaktív vegyületek képződnek. Az egyik ilyen a benzol-epoxid. Az epoxiciklus nagy szögfeszültsége miatt a -C-O-C- kötések felszakadnak és a molekula elektrofillé válik, könnyen reakcióba lép a molekulák nitrogénbázisainak nukleofil központjaival. nukleinsavak különösen a DNS.
Az epoxiciklus nukleofil központokkal - nitrogénbázisok aminocsoportjaival való kölcsönhatásának mechanizmusa (arilezési reakció) nukleofil szubsztitúciós reakcióként megy végbe. 2 . Ennek eredményeként meglehetősen erős kovalens kötésű DNS-adduktok képződnek, ilyen származékok leggyakrabban a guaninban figyelhetők meg (mivel a guanin molekula maximális összeget nukleofil centrumok), például N7-fenilguanin. A keletkező DNS-adduktumok a DNS natív szerkezetének megváltozásához vezethetnek, ezáltal megzavarhatják a transzkripció és a replikáció megfelelő lefolyását. Mi a genetikai mutációk forrása. Az epoxid felhalmozódása a hepatocitákban (májsejtekben) visszafordíthatatlan következményekhez vezet: a DNS arilációjának növekedése, és ezzel egyidejűleg a genetikai mutáció termékeiként létrejövő mutáns fehérjék expressziójának (túlexpressziójának) növekedése; az apoptózis gátlása; sejttranszformáció, sőt halál. A kifejezett, kifejezett genotoxicitás és mutagenitás mellett a benzol erős mielotoxicitást és karcinogén aktivitást mutat, különösen ez a hatás a mieloid szövet sejtjeiben nyilvánul meg (e szövet sejtjei nagyon érzékenyek a xenobiotikumok ilyen hatásaira).
A benzol és a szerhasználat
A benzol kábító hatással van az emberre, és kábítószer-függőséghez vezethet.
Akut mérgezés
Nagyon magas koncentrációban - szinte azonnali eszméletvesztés és néhány percen belüli halál. Az arc színe cianotikus, a nyálkahártya gyakran cseresznyevörös. Alacsonyabb koncentrációban - az alkoholhoz hasonló izgalom, majd álmosság, általános gyengeség, szédülés, hányinger, hányás, fejfájás, eszméletvesztés. Izomrángásokat is megfigyelnek, amelyek tónusos görcsökké válhatnak. A pupillák gyakran kitágultak és nem reagálnak a fényre. A légzés először felgyorsul, majd lelassul. A testhőmérséklet élesen csökken. Felgyorsult pulzus, kis töltet. A vérnyomás csökken. Súlyos szívritmuszavarok eseteiről számoltak be.
Súlyos, közvetlenül nem halálhoz vezető mérgezést követően időnként hosszan tartó egészségi rendellenességek figyelhetők meg: mellhártyagyulladás, felső légúti hurutok, szaruhártya- és retinabetegségek, májkárosodás, szívbetegségek stb. Vazomotoros eset. neurózis az arc és a végtagok duzzanatával, érzékenységi zavarokkal és görcsökkel röviddel akut benzolgőz-mérgezés után. Néha a halál egy idő után a mérgezés után következik be.
krónikus mérgezés
Súlyos esetekben: fejfájás, erős fáradtság, légszomj, szédülés, gyengeség, idegesség, álmosság vagy álmatlanság, emésztési zavarok, hányinger, néha hányás, étvágytalanság, fokozott vizeletürítés, menstruáció, tartós vérzés a szájnyálkahártyából, különösen az íny, gyakran kialakul. , és az orr, órákig, sőt napokig tart. Néha tartós vérzés lép fel a foghúzás után. Számos apró vérzés (vérzés) a bőrben. Vér a székletben, méhvérzés, retinavérzés. Általában a vérzés, és gyakran az ezzel járó láz (40 °C-ig és afölötti hőmérséklet) az, ami miatt a mérgezett kórházba kerül. Ilyen esetekben a prognózis mindig komoly. A halál oka olykor másodlagos fertőzések: előfordulnak periosteum gangrén gyulladása és állkapocs nekrózisa, súlyos fekélyes ínygyulladás, általános szepszis szeptikus endometritissel.
Néha súlyos mérgezés esetén idegrendszeri betegségek tünetei alakulnak ki: az ínreflexek növekedése, kétoldali klónusz, pozitív Babinsky-tünet, mélyérzékenységi rendellenesség, pszeudo-tabetikus rendellenességek paresztéziával, ataxia, paraplégia és motoros rendellenességek (a szövetkárosodás jelei). a gerincvelő hátsó oszlopai és a piramispálya).
A legjellemzőbb változások a vérben. Az eritrociták száma általában élesen csökken, 1-2 millióra vagy az alá. A hemoglobin tartalma is meredeken csökken, néha akár 10%-ot is. A színindex egyes esetekben alacsony, néha a normálhoz közeli, néha pedig magas (különösen súlyos vérszegénység esetén). Anizocitózis és poikilocitózis, bazofil punkció és nukleáris eritrociták megjelenése, a retikulociták számának és az eritrociták térfogatának növekedése figyelhető meg. Jellemzőbb a leukociták számának éles csökkenése. Néha kezdetben leukocitózis, gyorsan felváltja a leukopenia, az ESR felgyorsulása. A vérben bekövetkező változások nem egyidejűleg alakulnak ki. Leggyakrabban a leukopoietikus rendszer korábban érintett, később thrombocytopenia csatlakozik. Az eritroblaszt funkció veresége gyakran még később következik be. A jövőben kialakulhat a súlyos mérgezés jellegzetes képe - aplasztikus anémia.
A mérgezés hatásai a benzollal végzett munka leállítása után hónapokkal és évekkel továbbra is fennállhatnak, sőt tovább is fejlődhetnek.
Elsősegély mérgezés és kezelés esetén
Akut benzolmérgezés (benzolgőz) esetén az áldozatot először friss levegőre kell vinni, légzésleállás esetén mesterséges lélegeztetést kell végezni a normalizálásra, légzésserkentőként oxigént és lobelint használnak. Az adrenalin fájdalomcsillapítóként való használata szigorúan tilos! Hányás esetén intravénásan 40%-os glükóz oldat, keringési zavarok esetén koffeinoldat injekció. Ha a mérgezés szájon át történt, és a benzol a gyomorba került, növényi olajjal le kell öblíteni (a benzol jól felszívódik), az eljárást óvatosan kell elvégezni, mivel aspiráció lehetséges. Enyhe mérgezés esetén a beteg nyugalmat mutat. Izgatott állapotban nyugtatókra van szükség. Vérszegénység esetén vérátömlesztést, B12-vitamint, folsavat, leukopenia esetén B6-vitamint, pentoxilt kell adni. Az immunitás csökkenése (immunhiányos állapot) esetén - immunstimulánsok.
A benzol hatása a biomembránokra
A biológiai membránok szupramolekuláris struktúrák - kettős lipidréteg, amelybe a fehérjék, poliszacharidok molekuláinak felületére integrálódnak (beágyazódnak) vagy rögzítődnek. A biomembránokat felépítő lipidek természetüknél fogva amfifil (amofil) vegyületek, vagyis a bennük lévő poláris csoportok jelenléte miatt poláris és nem poláris anyagokban egyaránt képesek oldódni, az ún. "fej"(karbonsav -COOH, hidroxil -OH, aminocsoportok -NH 2 és mások) és a nem poláris ún. "frakk"(szénhidrogén gyökök - alkilek, arilok, policiklusos szerkezetek, például kolesztán és mások).
A benzol a biológiai membránok hatékony szolubilizálója, gyorsan oldja a nem poláris csoportokat (az ún. "frakk") lipidek, főleg koleszterin, amely a membránok részét képezi. Az oldódási folyamatot a benzol koncentrációja korlátozza, minél több, annál gyorsabban megy végbe a folyamat. A szolubilizáció során energia szabadul fel, szó szerint megtöri a kettős lipidréteget (lipid kettős réteg), ami a membrán teljes pusztulásához (szerkezeti tönkremeneteléhez), majd sejtapoptózishoz vezet (a biomembránok pusztulása során a membránreceptorok aktiválódnak (pl. mint: CD95, TNFR1, DR3, DR4 és mások), amelyek aktiválják a sejt apoptózist).
Hatás a bőrön
A kéz benzollal való gyakori érintkezésekor száraz bőr, repedések, viszketés, bőrpír (általában az ujjak között), duzzanat és kölesszerű hólyagok figyelhetők meg. Néha bőrelváltozások miatt a dolgozók kénytelenek felmondani a munkájukat.
A megengedett legnagyobb koncentráció 5 mg/m 3.
Biztonság
A benzollal végzett munka mérgezés és súlyos egészségügyi problémák kockázatával jár. A benzol erősen illékony folyadék (illékonysága 320 mg/l 20°C-on) magas fok gyulladás, ezért a vele való munkavégzés során be kell tartani a gyúlékony folyadékokkal való munkavégzésre vonatkozó biztonsági óvintézkedéseket. A benzolgőzök nagy veszélyt jelentenek, mivel a levegővel robbanékony keveréket képezhetnek. Jelenleg a benzol szerves oldószerként való felhasználása erősen korlátozott gőzeinek mérgező és rákkeltő hatásai, valamint a bőrre gyakorolt negatív hatásai miatt. A laboratóriumi benzollal végzett munka szintén korlátozza (szigorúan szabályozva). A benzolt csak kis mennyiségben (legfeljebb 50 ml-ben) javasolt kísérletekben használni, a munkát kizárólag fluorgumikesztyűben szabad végezni (a latex benzol hatására feloldódik és megduzzad).
- hőforrás, nyílt láng közelében tárolandó, erős oxidálószerek, élelmiszeripari termékek és így tovább,
- hagyja nyitva a benzolt tartalmazó tartályokat, füstöljön,
- használjon benzolos tartályokat élelmiszerekhez, kézmosáshoz, mosogatáshoz,
- zárt, rosszul szellőző helyiségben, ahol a levegő hőmérséklete meghaladja a 30 ° C-ot,
- nagy mennyiségű anyagot használjon oldószerként,
- a kéz, a szem és a légzőszervek bőrének védőfelszerelése nélkül dolgozzon.
Ökológia
A benzol környezetre nem biztonságos anyag, antropogén eredetű mérgező anyag. A benzol fő forrásai a környezet co szennyvíz vagy a levegőbe történő kibocsátás a petrolkémiai és kokszipar, az üzemanyag-termelés és a szállítás. A tározókból a benzol könnyen elpárolog, talajból növényké alakulhat, ami komoly veszélyt jelent az ökoszisztémákra.
A benzol kumulációs tulajdonsággal rendelkezik, lipofil volta miatt képes lerakódni az állatok zsírszövetének sejtjeiben, ezáltal megmérgezi azokat.
PRTSVSH (F) FGBOU VPO
"Tűzbiztonsági osztály"
Teszt
az "Égés és robbanás elmélete" tudományágban
1. számú feladat
Határozza meg a benzolgőz teljes elégetéséhez szükséges fajlagos elméleti mennyiségeket és levegőmennyiséget! A levegő elhelyezkedési körülményeit a Tv hőmérséklet és a Pv nyomás, a benzolgőz pedig a Tg hőmérséklet és a Pg nyomás jellemzi. A számítási eredményeket a következő mértékegységekben fejezze ki: ; ;;;
Kiinduló adatok (N - csoportszám, n - létszám a tanulók névsora szerint:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Pv = 10 3 = 95900 Pa;
Тg = 300 α (a 1) N α 2 ( α 1) n α 0,2 n = 321,6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
С6Н6+7.5О2+7.5?3.76N2=6CO2+3pO+7.5?3.76N2+Qp (1),
ahol Qp a kémiai reakció hője. Tól től adott egyenlet meghatározható a benzol és a molekuláris oxigén sztöchiometrikus együtthatója: Vg = 1, V0 = 7,5
2. Fajlagos elméleti levegőmennyiség - az egy kilomol benzol teljes elégetéséhez szükséges levegő kilomoljainak számát a következő képlettel számítjuk ki:
ahol 4,76 az egységnyi oxigént tartalmazó levegő mennyisége, \u003d a molekuláris oxigén (Vo) és a benzol (Vg) sztöchiometrikus együtthatóinak aránya
A (d) pontban a Vo és Vg értékét behelyettesítve a következőket kapjuk:
3. Egy kilomól benzol teljes elégetéséhez szükséges levegőmennyiséget a következőképpen határozzuk meg:
ahol egy kilomol levegő térfogata Tv hőmérsékleten és Pv nyomáson. Az érték kiszámítása a képlet segítségével történik
ahol 22,4 a gáz moláris térfogata normál körülmények között, Po = 101325 Pa a normál nyomás, To = 273 K a normál hőmérséklet.
Ha behelyettesítjük a Tv-t, To-t, Pv-t, Po-t az (5)-ben, azt kapjuk
A fajlagos elméleti levegőmennyiséget a (4) képlettel számítjuk ki:
4. Az egységnyi térfogatú gáz-halmazállapotú tüzelőanyag teljes elégetéséhez szükséges levegőmennyiséget a következőképpen kell meghatározni:
ahol egy kilomól üzemanyag térfogata - benzolgőz Tg hőmérsékleten és Pg nyomáson. Tekintettel arra
és (8) és (5) helyett (7) a következő kifejezést kapjuk a fajlagos elméleti levegőmennyiségre:
Kiszámítjuk az égési folyamat ezen paraméterének értékét:
Egy kilogramm benzol teljes elégetéséhez szükséges levegőmennyiséget a következőképpen határozzuk meg:
ahol - az üzemanyag moláris tömege egy kilomól benzol tömege, kilogrammban kifejezve. A benzol móltömege számszerűen megegyezik molekulatömegével, a következő képlettel lehet meghatározni:
Ac?nc + An?nn, UiAi?ni (11)
ahol Ac és An a szén és hidrogén atomtömege, nc és nn a szénatomok száma a benzolmolekulában. Az Ac = 12, nc = 6, An = 1, nn = 6 értékeket behelyettesítve a következőt kapjuk:
A levegő fajlagos elméleti térfogatát úgy találjuk meg, hogy n értékeit behelyettesítjük a (10) képletbe:
A számítás eredménye:
2. számú feladat
Határozza meg a benzol égéstermékeinek fajlagos elméleti mennyiségét, térfogatát és összetételét, ha ismert a levegőtöbblet c együtthatója, az égéstermékek hőmérséklete Tp és nyomása Pp, a benzolgőz Tg hőmérséklete és Pg nyomása! A számítási eredményeket fejezze ki móltörtekben (százalékban) és a következő mértékegységekben: ; ;;
Kiinduló adatok:
c = 1,5 + (a 1) N - 0,1 - N 2 (a 1) n - 0,01 - n = 0,2;
Rp = 10 3 \u003d 68400 Pa;
Tp = 1600 α (a 1) N 2 0 β (α 1) n α 2 n = 1816 K;
Тg = 273 β (a 1) N 2 2 N + ( 1 ) n 0,2 n = 295,4 K;
Rg = 10 3 = 111600 Pa;
oldat (N=11, n=2).
1. Felírjuk a benzol levegőben történő égésének reakciójának sztöchiometrikus egyenletét:
C 6 H 6 + 7,5 O 2 + 7,5 - 3,76 N 2 = 6CO 2 + 3 H 2 O + 7,5 - 3,76 N 2 + Qp, (1)
ahol Qp a kémiai reakció hője. Ebből az egyenletből a következő sztöchiometrikus együtthatókat határozzuk meg:
V CO2 \u003d 6, V pO \u003d 3, V C6H6 \u003d 1, V O2 \u003d 7,5, V N2 \u003d 7,5? 3,76
2. Határozza meg egy kilomol tüzelőanyag égéstermékeinek becsült mennyiségét:
A (2) pontban az égéstermékek és a tüzelőanyag sztöchiometrikus együtthatóinak értékeit behelyettesítve a következőket kapjuk:
3. Fajlagos elméleti levegőmennyiség - egy kilomol tüzelőanyag teljes elégetéséhez szükséges kilomol levegő mennyiségét a következő képlet segítségével határozzuk meg:
ahol 4,76 az egységnyi oxigént tartalmazó levegő mennyisége,
A molekuláris oxigén és a benzol sztöchiometrikus együtthatóinak aránya.
Ha a (4)-ben behelyettesítjük a V O2 =7,5 és V C6H6 =1 értékeket, a következőt kapjuk:
4. Az 1 Kmol üzemanyagra eső többlet levegő mennyiségét a következő kifejezés határozza meg:
benzol gőz égési levegő
Ebben a kifejezésben az értékeket helyettesítve
37,7(0,2-1)=30,16(7)
5. A tüzelőanyag egységnyi mennyiségére jutó égéstermékek teljes mennyiségét a következő összeg határozza meg:
Az értékek behelyettesítése után a következőt kapjuk:
6. Az égéstermékek százalékban kifejezett móltörtjeit a következőképpen kell meghatározni:
A (9) képletekben az égéstermékekben lévő nitrogén és oxigén mólfrakcióira 0,79 és 0,21 ezeknek az anyagoknak a levegőben lévő mólfrakciói, amelyek feleslege a nitrogén arányának növekedéséhez és az oxigén megjelenéséhez vezet. az égéstermékekben.
7. A fajlagos égéstérfogatok és égéstermékek meghatározásához ki kell számítani azok moláris térfogatát - egy kilomol gáz térfogatát olyan körülmények között, amelyek között a termékek találhatók:
ahol 22,4 egy kilomol gáz térfogata normál körülmények között, T 0 \u003d 273K - normál hőmérséklet, Po \u003d 101325 Pa - normál nyomás.
A (10)-ben a Po, To értékeket behelyettesítve a következőket kapjuk:
Az egy kilogramm tüzelőanyag elégetése során keletkező termékek térfogatát a felesleges levegő nélkül számítják ki:
ahol - az üzemanyag moláris tömege egy kilomól benzol tömege, kilogrammban kifejezve. A benzol moláris tömegét a következő képlet határozza meg:
ahol Ac és An a szén (12) és a hidrogén (1) atomtömege, nc és n n a szén (6) és a hidrogén (6) atomok száma a benzolmolekulákban (C 6 H 6).
Az értékeket behelyettesítve a (12)-ben kapjuk
Az 1 kilogramm üzemanyagra jutó többlet levegő mennyiségét a következőképpen határozzuk meg:
ahol egy kilomól felesleges levegő térfogata, amely az égéstermékek részét képezi. Mivel a felesleges levegő hőmérséklete és nyomása megfelel az égéstermékek hőmérsékletének és nyomásának, akkor \u003d \u003d 220,7.
Ezt az értéket behelyettesítve, valamint a (14) pontban is, a következőt kapjuk:
Az üzemanyag teljes égéséből származó termékek fajlagos térfogatának kiszámításához feltételezzük, hogy a benzolgőz hőmérséklete Tg nyomáson:
ahol egy kilomól benzolgőz térfogata Tg hőmérsékleten és Pg nyomáson. Az üzemanyag moláris térfogatát a következő képlettel számítjuk ki:
A kapott értéket és a (17) pontban szereplő értékeket behelyettesítve a következőket kapjuk:
Felesleges levegőmennyiség egyenként köbméter benzolgőz a következőképpen definiálható:
Behelyettesítés (20) értékben\u003d 30,16, \u003d és
a következő eredményt adja:
Az égéstermékek teljes fajlagos térfogatát, figyelembe véve a levegőfelesleget, az összeg határozza meg
A számítás eredménye:
X CO2 \u003d%; X H2O \u003d 4,4%; X N2 =%; X O2 \u003d 11,7%
Hasonló dokumentumok
A nitrobenzol C6H5NO2 és a CS2 szén-diszulfid éghetőségi együtthatójának kiszámítása. A propil-acetát levegőben történő égési reakciójának egyenlete. A levegő és az égéstermékek térfogatának kiszámítása éghető gáz égése során. A toluol lobbanáspontjának meghatározása V. Blinov képlete szerint.
teszt, hozzáadva: 2017.08.04
Anyag égése során keletkező levegő és égéstermékek térfogatának kiszámítása. Az etilénglikol levegőben történő égési reakciójának egyenlete. Éghető gázok keverékének elégetése. Sztöchiometrikus keverék adiabatikus égési hőmérsékletének kiszámítása. a propanol elégetése.
teszt, hozzáadva 2012.10.17
Az égés típusa és főbb paraméterei. Az üzemanyag és az oxidálószer kémiai átalakítása égéstermékekké. Az égési reakció anyag- és hőmérlegének egyenletei. A levegőfelesleg együtthatójának hatása az égéstermékek összetételére és az égési hőmérsékletre.
teszt, hozzáadva: 2013.01.17
Egy egységnyi éghető anyag teljes elégetéséhez szükséges levegő térfogatának meghatározása. Egy éghető anyag egységnyi tömegének égéstermékeinek összetétele. Gáz, gőz, por-levegő keverékek lángterjedési határai. Robbanásveszélyes bomlási nyomás.
szakdolgozat, hozzáadva 2013.12.23
Tűz- és robbanásveszély-megelőzési intézkedések kidolgozása, kialakulásuk és eloltásuk feltételeinek felmérése. A kiégési arány fogalma, meghatározásának módja. Az égési reakcióegyenlet összeállításának eljárása. A gyújtáshoz szükséges levegő mennyiségének kiszámítása.
szakdolgozat, hozzáadva 2014.10.07
A gáz teljes égéséből származó termékek összetételének meghatározása. Egy gázelegy adiabatikus égési hőmérsékletének kiszámítása állandó térfogatú és állandó nyomáson. Földgáz öngyulladásának kinetikus reakcióállandói. A gázkeverék gyulladási határa.
szakdolgozat, hozzáadva 2014.02.19
A benzol propilénnel történő alkilezésének ipari módszereinek jellemzése. A benzol olefinekkel történő alkilezésének elvei a kémiai technológiában. A benzolalkilezés technológiai berendezéseinek tervezésének problémái. A gyártási folyamat technológiájának leírása.
szakdolgozat, hozzáadva: 2010.11.15
Az égés erőteljes oxidációs folyamat. Égési módok: parázslás és lánggal égetés. A robbanás, mint az égés speciális esete. A láng elektromos tulajdonságai. Különféle égéstermékek az üzemanyag tökéletlen égése következtében. Füst szűrése vízen keresztül.
tudományos munka, hozzáadva 2009.07.29
Adott mennyiségű propán teljes elégetéséhez szükséges levegő térfogatának meghatározása. Az entalpia, entrópia és Gibbs-energia változásának kiszámítása a Hess-törvény következményeinek felhasználásával. Az oxidálószer és a redukálószer moláris tömegegyenértékének meghatározása.
teszt, hozzáadva: 2012.02.08
Az abszorbens olaj felhasználásának, a benzol koncentrációjának meghatározására szolgáló módszerek az abszorbensből kilépő abszorbens olajban. A tömített abszorber átmérőjének és magasságának kiszámítása. A szükséges fűtőfelület meghatározása az oszlop kockájában és a fűtőgőz felhasználása.
Bemutatjuk a figyelmedbe egy oktatóvideót a témában " Kémiai tulajdonságok Benzol". Ennek a videónak a segítségével képet kaphat a benzol kémiai tulajdonságairól, valamint azokról a kemény körülményekről, amelyek szükségesek ahhoz, hogy a benzol reagáljon más anyagokkal.
Téma:aromás szénhidrogének
Lecke:A benzol kémiai tulajdonságai
Rizs. 1. Benzol molekula
A p-elektronfelhő feltörése a benzolmolekulában nehéz. Ezért a benzol sokkal kevésbé aktívan lép be a kémiai reakciókba, mint a telítetlen vegyületek.


Ahhoz, hogy a benzol kémiai reakciókba léphessen, meglehetősen kemény körülményekre van szükség: megemelt hőmérsékletre és sok esetben katalizátorra. A legtöbb reakcióban a stabil benzolgyűrű megmarad.
1. Brómozás.

Katalizátor (vas(III) vagy alumínium-bromid) szükséges, és még kis mennyiségű víz sem engedhető be. A katalizátor szerepe az, hogy a bróm molekulát az egyik bróm atom vonzza a vasatomhoz. Ennek eredményeként polarizálódik - egy pár kötéselektron átjut a vashoz kapcsolódó bróm atomhoz:
Br+…. Br - FeBr 3 .
A Br+ erős elektrofil. Vonzódik a benzolgyűrű hatelektronos felhőjéhez, és megtöri, kialakul kovalens kötés szénatommal:
A bróm anion csatlakozhat a kapott kationhoz. De a benzolgyűrű aromás rendszerének redukciója energetikailag kedvezőbb, mint a bróm anion hozzáadása. Ezért a molekula egy hidrogénion kidobásával stabil állapotba kerül:
A benzolgyűrűben minden elektrofil szubsztitúciós reakció hasonló mechanizmus szerint megy végbe.
2. Nitrálás

A benzol és homológjai tömény kénsav és salétromsav keverékével (nitráló keverék) reagálnak. A nitráló keverékben egyensúlyban van egy NO 2 + nitróniumion, amely elektrofil:

3. Szulfonálás.
A benzol és más arének melegítéskor reagálnak tömény kénsavval vagy óleummal - SO 3 kénsavban készült oldatával:

4 . Friedel-Crafts alkilezés
5. Alkilezés alkénekekkel

Ezek a reakciók energetikailag kedvezőtlenek, ezért csak hevítés vagy besugárzás hatására mennek végbe.
1. Hidrogénezés.
Hevítéskor, emelt nyomáson és Ni-, Pt- vagy Pd-katalizátor jelenlétében a benzol és más arének hidrogént adnak hozzá, hogy ciklohexánt képezzenek:

2. A benzol klórozása.
Ultraibolya sugárzás hatására a benzol klórt ad hozzá. Ha a klór benzolos oldatát tartalmazó kvarcüveg lombikot napfény éri, az oldat gyorsan elszíneződik, a klór benzollal egyesülve 1,2,3,4,5,6-hexaklór-ciklohexánt képez, amelyet ún. hexaklórán(korábban rovarölő szerként használták):

3. égő benzol.
Az alkánokkal ellentétben a benzol és más aromás szénhidrogének lángja fényes és füstös.
Összegezve a tanulságot
Ebben a leckében a „Benzol kémiai tulajdonságai” témát tanulmányozta. Ennek az anyagnak a használatával képet kaphatott a benzol kémiai tulajdonságairól, valamint azokról a kemény körülményekről, amelyek szükségesek ahhoz, hogy a benzol reakcióba lépjen más anyagokkal.
Bibliográfia
1. Rudzitis G.E. Kémia. Alapok Általános kémia. 10. évfolyam: tankönyv a oktatási intézmények: alapszint / G. E. Rudzitis, F.G. Feldman. - 14. kiadás. - M.: Oktatás, 2012.
2. Kémia. 10. fokozat. Profil szint: tankönyv. általános műveltségre intézmények / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin és mások - M.: Drofa, 2008. - 463 p.
3. Kémia. 11. évfolyam. Profil szint: tankönyv. általános műveltségre intézmények / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin és mások - M.: Drofa, 2010. - 462 p.
4. Khomchenko G.P., Khomchenko I.G. Kémiai feladatgyűjtemény egyetemekre jelentkezők számára. - 4. kiadás - M.: RIA "Új hullám": Umerenkov kiadó, 2012. - 278 p.
Házi feladat
1. 13., 14. sz. (62. o.) Rudzitis G.E., Feldman F.G. Kémia: Szerves kémia. 10. évfolyam: tankönyv oktatási intézmények számára: alapfok / G. E. Rudzitis, F.G. Feldman. - 14. kiadás. - M.: Oktatás, 2012.
2. Miért különböznek az aromás vegyületek kémiai tulajdonságaikban a telített és a telítetlen szénhidrogénektől?
3. Írja fel az etil-benzol és a xilol égési reakcióinak egyenleteit!
MEGHATÁROZÁS
Benzol(ciklohexatrién - 1,3,5) - szerves anyag, számos aromás szénhidrogén legegyszerűbb képviselője.
Képlet - C 6 H 6 (szerkezeti képlet - 1. ábra). Molekulatömeg – 78, 11.
Rizs. 1. A benzol szerkezeti és térbeli képlete.
A benzolmolekulában mind a hat szénatom sp 2 hibrid állapotban van. Minden szénatom 3σ kötést alkot két másik szénatommal és egy hidrogénatommal, amelyek ugyanabban a síkban helyezkednek el. Hat szénatom szabályos hatszöget alkot (a benzolmolekula σ-váza). Minden szénatomnak van egy nem hibridizált p-pályája, amely egy elektront tartalmaz. Hat p-elektron egyetlen π-elektronfelhőt (aromás rendszert) alkot, amelyet egy hattagú cikluson belül körként ábrázolnak. A benzolból származó szénhidrogéncsoportot C 6 H 5 - - fenilnek (Ph-) nevezik.
A benzol kémiai tulajdonságai
A benzolra az elektrofil mechanizmus szerint lezajló szubsztitúciós reakciók jellemzőek:
- halogénezés (a benzol kölcsönhatásba lép klórral és brómmal katalizátorok jelenlétében - vízmentes AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- nitrálás (a benzol könnyen reagál nitráló keverékkel - tömény salétromsav és kénsav keveréke)

- alkének alkének
C6H6 + CH2 = CH-CH3 → C6H5-CH (CH3)2;
A benzolhoz való addíciós reakciók az aromás rendszer tönkremeneteléhez vezetnek, és csak zord körülmények között mennek végbe:
- hidrogénezés (a reakció hevítéskor megy végbe, a katalizátor Pt)

- klór hozzáadása (UV sugárzás hatására szilárd termék képződésével - hexaklór-ciklohexán (hexaklorán) - C 6 H 6 Cl 6)

Mint bármelyik szerves összetevő A benzol égési reakcióba lép, és reakciótermékként képződik szén-dioxidés víz (füstös lánggal ég):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
A benzol fizikai tulajdonságai
A benzol színtelen folyadék, de különleges szúrós szaga van. Vízzel azeotróp elegyet képez, jól keveredik éterekkel, benzinnel és különféle szerves oldószerekkel. Forráspont - 80,1 C, olvadáspont - 5,5 C. Mérgező, rákkeltő (azaz hozzájárul a rák kialakulásához).
A benzol beszerzése és felhasználása
A benzol előállításának fő módjai:
- hexán dehidrociklizálása (katalizátorok - Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 → C6H6 + 4H2;
- ciklohexán dehidrogénezése (a reakció hevítésre megy végbe, a katalizátor Pt)
C6H12 → C6H6 + 4H2;
- acetilén trimerizálása (a reakció 600 C-ra melegítve megy végbe, a katalizátor aktív szén)
3HC≡CH → C 6 H 6 .
A benzol alapanyagként szolgál homológok (etilbenzol, kumol), ciklohexán, nitrobenzol, klórbenzol és egyéb anyagok előállításához. Korábban a benzolt a benzin adalékaként használták az oktánszám növelésére, most azonban magas toxicitása miatt szigorúan szabályozzák az üzemanyag benzoltartalmát. Néha benzolt használnak oldószerként.
Példák problémamegoldásra
1. PÉLDA
| A feladat | Írja fel azokat az egyenleteket, amelyekkel a következő transzformációkat hajthatja végre: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Megoldás | Az acetilén metánból történő előállításához a következő reakciót alkalmazzuk: 2CH4 → C2H2+3H2 (t = 1400 °C). A benzol acetilénből történő kinyerése az acetilén trimerizációs reakciójával lehetséges, amely hevítéskor (t = 600 C) és aktív szén jelenlétében megy végbe: 3C 2 H 2 → C 6 H 6. A benzol klórozási reakcióját klór-benzol előállítására vas(III)-klorid jelenlétében hajtják végre: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
2. PÉLDA
| A feladat | 39 g benzolhoz vas(III)-klorid jelenlétében 1 mól brómos vizet adunk. Milyen mennyiségű anyag és hány gramm milyen termékekből származott ez? |
| Megoldás | Írjuk fel a benzol-brómozás reakciójának egyenletét vas(III)-klorid jelenlétében: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. A reakciótermékek a bróm-benzol és a hidrogén-bromid. A benzol móltömege a táblázat segítségével számítva kémiai elemek DI. Mengyelejev - 78 g/mol. Keresse meg a benzol anyag mennyiségét: n(C6H6) = m(C6H6)/M(C6H6); n(C6H6)=39/78=0,5 mol. A probléma körülményei szerint a benzol 1 mol brómmal reagált. Következésképpen a benzol hiánycikk, és a benzolra vonatkozóan további számításokat végeznek. Az n (C 6 H 6) reakcióegyenlet szerint n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1, tehát n (C 6 H 6) \u003d n (C 6 H 5) Br) \u003d: n(HBr) = 0,5 mol. Ekkor a bróm-benzol és a hidrogén-bromid tömege egyenlő lesz: m(C6H5Br) = n(C6H5Br)×M(C6H5Br); m(HBr)=n(HBr)×M(HBr). A bróm-benzol és a hidrogén-bromid móltömege, a D.I. kémiai elemeinek táblázata alapján számítva. Mengyelejev - 157 és 81 g/mol. m(C6H5Br)=0,5×157=78,5 g; m(HBr) = 0,5 x 81 = 40,5 g. |
| Válasz | A reakciótermékek a bróm-benzol és a hidrogén-bromid. A bróm-benzol és a hidrogén-bromid tömege 78,5, illetve 40,5 g. |
A reakciók első csoportja a szubsztitúciós reakciók. Azt mondtuk, hogy az arének nem tartalmaznak többszörös kötést a molekulaszerkezetben, hanem egy hat elektronból álló konjugált rendszert tartalmaznak, ami nagyon stabil és további erőt ad a benzolgyűrűnek. Ezért be kémiai reakciók először a hidrogénatomok kicserélődése történik, és nem a benzolgyűrű tönkremenetele.
Szubsztitúciós reakciókkal már találkoztunk az alkánokról beszélve, de náluk ezek a reakciók gyökös mechanizmus szerint zajlottak le, míg az aréneket a szubsztitúciós reakciók ionos mechanizmusa jellemzi.
Első kémiai tulajdonság - halogénezés. Hidrogénatom helyettesítése halogénatommal - klórral vagy brómmal.
A reakció hevítéssel és mindig katalizátor részvételével megy végbe. Klór esetében ez lehet alumínium-klorid vagy vas-klorid három. A katalizátor polarizálja a halogén molekulát, ami heterolitikus kötésszakadást és ionokat eredményez.
A pozitív töltésű kloridion reakcióba lép a benzollal.
Ha a reakció brómmal megy végbe, akkor a vas-tribromid vagy az alumínium-bromid katalizátorként működik.

Fontos megjegyezni, hogy a reakció molekuláris brómmal megy végbe, nem pedig brómos vízzel. A benzol nem lép reakcióba brómos vízzel.
A benzolhomológok halogénezésének megvannak a maga sajátosságai. A toluol molekulában a metilcsoport elősegíti a szubsztitúciót a gyűrűben, a reakcióképesség megnő, és a reakció enyhébb körülmények között, azaz már szobahőmérsékleten megy végbe.

Fontos megjegyezni, hogy a szubsztitúció mindig orto és para helyzetben történik, így izomerek keverékét kapjuk.
Második tulajdonság - benzol nitrálása, nitrocsoport bevitele a benzolgyűrűbe.

Nehéz, sárgás, keserű mandula illatú folyadék képződik - nitrobenzol, így a reakció minőségi lehet a benzol esetében. A nitráláshoz tömény salétromsav és kénsav nitráló keverékét használják. A reakciót melegítéssel hajtjuk végre.
Hadd emlékeztesselek arra, hogy az alkánok nitrálásához a Konovalov-reakcióban híg salétromsavat használtak kénsav hozzáadása nélkül.
A toluol nitrálásakor, valamint a halogénezés során orto- és para-izomerek keveréke képződik.

Harmadik tulajdonság - a benzol alkilezése halogén-alkánokkal.

Ez a reakció lehetővé teszi szénhidrogén gyök bejutását a benzolgyűrűbe, és a benzolhomológok előállításának módszerének tekinthető. Katalizátorként alumínium-kloridot használnak, amely elősegíti a halogén-alkán molekula ionokká való bomlását. Fűtést is igényel.
Negyedik tulajdonság - a benzol alkénekkel történő alkilezése.

Ily módon például kumolt vagy etil-benzolt nyerhetünk. A katalizátor alumínium-klorid.
2. A benzol hozzáadásának reakciói
A reakciók második csoportja az addíciós reakciók. Azt mondtuk, hogy ezek a reakciók nem jellemzőek, de igen zord körülmények között a pi-elektronfelhő pusztulása és hat szigma kötés kialakulásával lehetségesek.
Ötödik tulajdonság az általános listán - hidrogénezés, hidrogén hozzáadása.
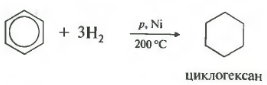
Hőmérséklet, nyomás, katalizátor nikkel vagy platina. A toluol ugyanúgy képes reagálni.
hatodik tulajdonság - klórozás. Felhívjuk figyelmét, hogy kifejezetten a klórral való kölcsönhatásról beszélünk, mivel a bróm nem lép be ebbe a reakcióba.

A reakció kemény ultraibolya besugárzás mellett megy végbe. Szilárd anyag, hexaklór-ciklohexán képződik, amely a hexaklórán másik neve.
Fontos megjegyezni, hogy a benzol esetében nem lehetséges hidrogén-halogenidek addíciós reakciói (hidrohalogénezés) és víz hozzáadása (hidratálás).
3. Szubsztitúció a benzolhomológok oldalláncában
A reakciók harmadik csoportja csak a benzolhomológokat érinti – ez az oldallánc helyettesítése.
hetedik az általános listán szereplő tulajdonság a halogénezés az oldallánc alfa-szénatomján.

A reakció hevítéskor vagy besugárzáskor megy végbe, és mindig csak az alfa-szénnél. Ahogy a halogénezés folytatódik, a második halogénatom visszatér alfa-helyzetbe.
4. A benzolhomológok oxidációja
A reakciók negyedik csoportja az oxidáció.
A benzolgyűrű túl erős, ezért benzol nem oxidálódik kálium-permanganát - nem színezi el az oldatát. Ezt nagyon fontos megjegyezni.
Másrészt a benzolhomológokat melegítéskor megsavanyított kálium-permanganát-oldattal oxidálják. És ez a nyolcadik kémiai tulajdonság.

Kiderül, hogy benzoesav. Az oldat elszíneződése figyelhető meg. Ilyenkor akármilyen hosszú is a szubsztituens szénlánca, az mindig az első szénatom után megszakad, és az alfa atom benzoesav képződésével karboxilcsoporttá oxidálódik. A molekula többi része a megfelelő savvá, vagy ha csak egy szénatom, akkor szén-dioxiddá oxidálódik.
Ha a benzolhomológ egynél több szénhidrogén szubsztituenst tartalmaz az aromás gyűrűn, akkor az oxidáció ugyanazon szabályok szerint megy végbe - az alfa-helyzetben lévő szén oxidálódik.

Ebben a példában egy kétbázisú aromás savat kapunk, amelyet ftálsavnak nevezünk.
Különleges módon megjegyzem a kumén, az izopropil-benzol oxidációját légköri oxigénnel kénsav jelenlétében.

Ez az úgynevezett kumén módszer a fenol előállítására. Általában ezzel a reakcióval kell foglalkozni a fenoltermeléssel kapcsolatos kérdésekben. Ez az ipari módszer.
kilencedik tulajdonság - égés, teljes oxidáció oxigén. A benzol és homológjai szén-dioxiddá és vízzé égnek.
Írjuk fel a benzol égésének egyenletét általános formában.
A tömegmegmaradás törvénye szerint a bal oldalon annyi atom legyen, ahány atom van a jobb oldalon. Mert végül is a kémiai reakciókban az atomok nem mennek sehova, hanem egyszerűen megváltozik a köztük lévő kötések sorrendje. Tehát annyi szén-dioxid molekula lesz, ahány szénatom egy arénmolekulában, mivel a molekula egy szénatomot tartalmaz. Ez n CO 2 molekula. Feleannyi vízmolekula lesz, mint hidrogénatom, azaz (2n-6) / 2, ami n-3-at jelent.
A bal és a jobb oldalon ugyanannyi oxigénatom található. A jobb oldalon 2n van a szén-dioxidból, mert minden molekulában két oxigénatom van, plusz n-3 vízből, összesen 3n-3. A bal oldalon ugyanannyi oxigénatom található - 3n-3, ami azt jelenti, hogy feleannyi molekula van, mivel a molekula két atomot tartalmaz. Azaz (3n-3)/2 oxigénmolekula.
Így összeállítottuk a benzolhomológok égésének egyenletét általános formában.