   |
|
| Tizimli Ism | benzol |
| Qisqartmalar | PhH |
| An'anaviy ismlar | fen mashinasi (Loran, 1837), fenil vodorod, benzol |
| Kimyo. formula | C₆H₆ |
| Davlat | suyuqlik |
| Molyar massa | 78,11 g/mol |
| Zichlik | 0,8786 g/sm³ |
| Dinamik yopishqoqlik | 0,0652 Pa s |
| Ionizatsiya energiyasi | 9,24 ± 0,01 eV |
| T. eritish. | 5,5° |
| T. kip. | 80,1° |
| T. rev. | −11° |
| T. svsp. | 562° |
| Va boshqalar. portlash | 1,2 ± 0,1 hajm% |
| Bug 'bosimi | 75 ± 1 mm Hg |
| Suvda eruvchanligi | 0,073 g/100 ml |
| GOST | GOST 5955-75 |
| Reg. CAS raqami | 71-43-2 |
| PubChem | 241 |
| Reg. EINECS raqami | 200-753-7 |
| TABASS | C1=CC=CC=C1 |
| InChI | |
| RTECS | CY1400000 |
| CHEBI | 16716 |
| ChemSpider | 236 |
| Toksiklik | toksik, kanserogen va narkotik xususiyatlarga ega |
| signal so'zi | XAVFLI! |
| Ma'lumotlar, agar boshqacha ko'rsatilmagan bo'lsa, standart sharoitlar (25 °, 100 kPa) uchun berilgan. | |
Kimyoviy xossalari
O'rin almashish reaktsiyalari benzolga xosdir - benzol alkenlar, xloroalkanlar, galogenlar, nitrat va sulfat kislotalar bilan reaksiyaga kirishadi. Benzol halqasining parchalanish reaksiyalari og'ir sharoitlarda (harorat, bosim) sodir bo'ladi.
- Alkenlar bilan o'zaro ta'sir qilish (alkillanish), reaksiya natijasida benzol gomologlari hosil bo'ladi, masalan, etilbenzol va kumen:
- Xlorbenzol hosil qilish uchun katalizator ishtirokida xlor va brom bilan o'zaro ta'sir qilish (elektrofil o'rinbosar reaktsiyasi):
- Katalizator bo'lmaganda, qizdirilganda yoki yoritilganda, geksaxlorotsiklogeksan izomerlari aralashmasi hosil bo'lishi bilan radikal qo'shilish reaktsiyasi sodir bo'ladi.
- Oleum eritmasida benzol brom bilan reaksiyaga kirishganda geksabromobenzol hosil bo‘ladi:
- Alkanlarning halogen hosilalari bilan o'zaro ta'siri (benzol alkilatsiyasi, Fridel-Krafts reaktsiyasi) alkilbenzollarni hosil qilish uchun:

- Benzol angidridlari, karboksilik kislota galogenidlarining Friedel-Krafts atsillanish reaktsiyasi aromatik va yog'li aromatik ketonlarning hosil bo'lishiga olib keladi:

6 6 + 6 5 COCl → AlCl 3 6 5 COC 6 5 + HCl
Birinchi va ikkinchi reaktsiyalarda asetofenon (metilfenil keton) hosil bo'lib, alyuminiy xloridni antimon xlorid bilan almashtirish reaktsiya haroratini 25 ° C ga kamaytirish imkonini beradi. Uchinchi reaksiyada benzofenon (difenil keton) hosil bo'ladi.
- Formillanish reaktsiyasi - benzolning CO va HCl aralashmasi bilan o'zaro ta'siri, yuqori bosimda va katalizator ta'sirida davom etadi, reaksiya mahsuloti benzaldegiddir:
- Sulfonlanish va nitrlanish reaktsiyalari (elektrofil o'rnini bosish):
- Benzolning vodorod bilan qaytarilishi (katalitik gidrogenlash):
Oksidlanish reaksiyalari
Benzol, tuzilishi tufayli, oksidlanishga juda chidamli, unga, masalan, kaliy permanganat eritmasi ta'sir qilmaydi. Biroq, malein angidridga oksidlanish vanadiy oksidi katalizatori yordamida amalga oshirilishi mumkin:

- ozonoliz reaktsiyasi. Bundan tashqari, benzol ozonolizga uchraydi, lekin jarayon to'yinmagan uglevodorodlarga qaraganda sekinroq:

Reaksiya natijasida dialdegid - glyoksal (1,2-etandial) hosil bo'ladi.
- yonish reaktsiyasi. Benzolning yonishi oksidlanishning cheklovchi holatidir. Benzol juda tez alangalanadi va havoda juda tutunli alanga bilan yonadi:
Tuzilishi
Tarkibi bo'yicha benzol to'yinmagan uglevodorodlarga (homolog qatorlar) kiradi n 2n-6), lekin etilen qatorining uglevodorodlaridan farqli o'laroq, 2 4, u to'yinmagan uglevodorodlarga xos xususiyatlarni ko'rsatadi (ular qo'shilish reaktsiyalari bilan tavsiflanadi), faqat og'ir sharoitlarda, lekin benzol almashtirish reaktsiyalariga ko'proq moyil bo'ladi. Benzolning bunday “xatti-harakati” uning maxsus tuzilishi bilan izohlanadi: bir tekislikda atomlarning mavjudligi va strukturada konjugatsiyalangan 6p-elektron bulutining mavjudligi. Benzoldagi bog'larning elektron tabiati haqidagi zamonaviy g'oya Linus Paulingning gipotezasiga asoslanadi, u benzol molekulasini chizilgan doira bilan olti burchakli tasvirlashni taklif qildi va shu bilan qattiq qo'sh aloqalar yo'qligini va borligini ta'kidladi. tsiklning barcha oltita uglerod atomini qoplaydigan yagona elektron buluti.
Maxsus va ommabop adabiyotlarda atama benzol halqasi, qoida tariqasida, uglerod atomlari bilan bog'liq bo'lgan boshqa atomlar va guruhlarni hisobga olmagan holda, benzolning uglerod tuzilishiga ishora qiladi. Benzol halqasi turli xil birikmalarning bir qismidir.
Ishlab chiqarish
Bugungi kunda bir nechta asosiy narsalar mavjud turli yo'llar bilan benzol ishlab chiqarish.

Ilova

Benzolni tashish temir yo'l orqali ixtisoslashtirilgan tank vagonlarida amalga oshiriladi
Olingan benzolning katta qismi boshqa mahsulotlarni sintez qilish uchun ishlatiladi:
- benzolning taxminan 50% etilbenzolga aylanadi (benzolni etilen bilan alkillash);
- taxminan 25% benzol kumenga aylanadi (benzolni propilen bilan alkillash);
- benzolning taxminan 10-15% siklogeksanga gidrogenlanadi;
- benzolning taxminan 10% nitrobenzol ishlab chiqarishga sarflanadi;
- 2-3% benzol chiziqli alkilbenzollarga aylanadi;
- xlorbenzol sintezi uchun taxminan 1% benzol ishlatiladi.
Juda kichikroq miqdorda, benzol ba'zi boshqa birikmalarni sintez qilish uchun ishlatiladi. Ba'zan va o'ta og'ir holatlarda, yuqori toksikligi tufayli, benzol erituvchi sifatida ishlatiladi.
Bundan tashqari, benzol benzinning bir qismidir. 1920-1930-yillarda benzinning oktan miqdorini oshirish uchun benzinga ru de qoʻshildi, ammo 1940-yillarga kelib bunday aralashmalar yuqori oktanli benzinlar bilan raqobatlasha olmadi. Yuqori toksiklik tufayli yoqilg'i tarkibidagi benzol miqdori zamonaviy standartlar bilan 1% gacha joriy etish bilan cheklangan.
Biologik ta'sir va toksikologiya
Benzol eng keng tarqalgan antropogen ksenobiotiklardan biridir.
Benzol juda zaharli hisoblanadi. Og'iz orqali yuborish uchun minimal o'ldiradigan doz 15 ml, o'rtacha 50-70 ml. Benzol bug'ining qisqa muddatli inhalatsiyasi bilan darhol zaharlanish sodir bo'lmaydi, shuning uchun yaqin vaqtgacha benzol bilan ishlash tartibi ayniqsa tartibga solinmagan. Katta dozalarda benzol ko'ngil aynishi va bosh aylanishiga olib keladi va ba'zi og'ir holatlarda zaharlanish o'limga olib kelishi mumkin. Benzol bilan zaharlanishning birinchi belgisi ko'pincha eyforiya hisoblanadi. Benzol bug'i buzilmagan teriga kirishi mumkin. Suyuq benzol terini juda bezovta qiladi. Agar inson tanasi oz miqdorda benzolning uzoq muddatli ta'siriga duchor bo'lsa, oqibatlari ham juda jiddiy bo'lishi mumkin.
Benzol kuchli kanserogendir. Tadqiqotlar benzolning aplastik anemiya, o'tkir leykemiya (miyeloid, limfoblastik), surunkali miyeloid leykemiya, miyelodisplastik sindrom va suyak iligi kasalliklari kabi kasalliklar bilan bog'liqligini ko'rsatadi.
Benzolning transformatsiyalanish mexanizmi va mutagen ta'siri
Inson tanasida benzolni o'zgartirish mexanizmining bir nechta variantlari mavjud. Birinchi variantda benzol molekulasi P450 sitoxromi ishtirokida mikrosomal oksidlanish tizimi tomonidan gidroksillanadi. Mexanizmga ko'ra, birinchi navbatda benzol yuqori reaktiv epoksidga oksidlanadi, keyinchalik u fenolga aylanadi. Bundan tashqari, reaksiyaga ko'ra P450 ning yuqori faollashuvi tufayli erkin radikallar (reaktiv kislorod turlari) hosil bo'ladi:
Benzol mutagenezining molekulyar mexanizmi
Benzol bu promutagen, u faqat biotransformatsiyadan so'ng mutagen xususiyatga ega bo'ladi, buning natijasida yuqori reaktiv birikmalar hosil bo'ladi. Ulardan biri benzol epoksididir. Epoksi siklining yuqori burchak kuchlanishi tufayli -C-O-C- aloqalari uziladi va molekula elektrofilga aylanadi, u molekulalarning azotli asoslarining nukleofil markazlari bilan oson reaksiyaga kirishadi. nuklein kislotalar ayniqsa DNK.
Epoksi siklining nukleofil markazlar - azotli asoslarning aminokislotalari (arillanish reaktsiyasi) bilan o'zaro ta'sir qilish mexanizmi nukleofil almashtirish reaktsiyasi sifatida davom etadi. 2 . Natijada, ancha kuchli kovalent bog'langan DNK qo'shimchalari hosil bo'ladi, bunday hosilalar ko'pincha guaninda kuzatiladi (chunki guanin molekulasida maksimal miqdor nukleofil markazlar), masalan, N7-fenilguanin. Natijada paydo bo'lgan DNK qo'shimchalari DNKning mahalliy tuzilishining o'zgarishiga olib kelishi mumkin va shu bilan transkripsiya va replikatsiyaning to'g'ri yo'nalishini buzishi mumkin. Genetik mutatsiyalar manbai nima. Gepatotsitlarda (jigar hujayralarida) epoksidning to'planishi qaytarilmas oqibatlarga olib keladi: DNK arilatsiyasining kuchayishi va shu bilan birga genetik mutatsiya mahsuloti bo'lgan mutant oqsillarning ekspressiyasining (ortiqcha ifodalanishi) kuchayishi; apoptozni inhibe qilish; hujayra o'zgarishi va hatto o'lim. Aniq genotoksiklik va mutagenlikdan tashqari, benzol kuchli miyelotoksiklik va kanserogen faollikka ega, ayniqsa bu ta'sir miyeloid to'qimalarning hujayralarida namoyon bo'ladi (bu to'qimalarning hujayralari ksenobiotiklarning bunday ta'siriga juda sezgir).
Benzol va moddalarni suiiste'mol qilish
Benzol odamga ahmoqona ta'sir ko'rsatadi va giyohvandlikka olib kelishi mumkin.
O'tkir zaharlanish
Juda yuqori konsentratsiyalarda - deyarli bir zumda ongni yo'qotish va bir necha daqiqada o'lim. Yuzning rangi siyanotik, shilliq pardalar ko'pincha gilos qizil. Pastroq konsentratsiyalarda - alkogolga o'xshash qo'zg'alish, keyin uyquchanlik, umumiy zaiflik, bosh aylanishi, ko'ngil aynishi, qusish, bosh og'rig'i, ongni yo'qotish. Tonik konvulsiyalarga aylanishi mumkin bo'lgan mushaklarning chayqalishi ham kuzatiladi. Ko'z qorachig'i ko'pincha kengayadi va yorug'likka javob bermaydi. Nafas olish avval tezlashadi, keyin sekinlashadi. Tana harorati keskin pasayadi. Puls tezlashdi, kichik to'ldirish. Qon bosimi pasayadi. Og'ir yurak aritmiyasi holatlari qayd etilgan.
To'g'ridan-to'g'ri o'limga olib kelmaydigan og'ir zaharlanishdan so'ng, ba'zida uzoq muddatli sog'liqning buzilishi kuzatiladi: plevrit, yuqori nafas yo'llarining kataralari, shox parda va ko'zning to'r pardasi kasalliklari, jigar shikastlanishi, yurak kasalliklari va boshqalar. Vazomotor holat. yuz va ekstremitalarning shishishi bilan nevroz, benzol bug'ining o'tkir zaharlanishidan ko'p o'tmay, sezgirlik va konvulsiyalar buzilishi. Ba'zida o'lim zaharlanishdan biroz vaqt o'tgach sodir bo'ladi.
surunkali zaharlanish
Og'ir holatlarda: bosh og'rig'i, haddan tashqari charchoq, nafas qisilishi, bosh aylanishi, zaiflik, asabiylashish, uyquchanlik yoki uyqusizlik, ovqat hazm qilish buzilishi, ko'ngil aynishi, ba'zida qusish, ishtahaning etishmasligi, siyishning kuchayishi, hayz ko'rish, og'iz bo'shlig'i shilliq qavatidan doimiy qon ketish, ayniqsa. milklar tez-tez rivojlanadi. , va burun, soatlab va hatto kunlar davom etadi. Ba'zida tish chiqarishdan keyin doimiy qon ketish paydo bo'ladi. Terida ko'p sonli mayda qon ketishlar (qon ketishlar). Najasdagi qon, bachadondan qon ketishi, retinal qon ketishi. Odatda, qon ketishi va tez-tez hamroh bo'lgan isitma (harorat 40 ° gacha va undan yuqori) zaharlanganlarni kasalxonaga olib keladi. Bunday hollarda prognoz har doim jiddiydir. O'lim sababi ba'zan ikkilamchi infektsiyalar: periosteumning gangrenoz yallig'lanishi va jag'ning nekrozi, milklarning og'ir yarali yallig'lanishi, septik endometrit bilan umumiy sepsis holatlari mavjud.
Ba'zida og'ir zaharlanish bilan asab kasalliklarining alomatlari rivojlanadi: tendon reflekslarining kuchayishi, ikki tomonlama klonus, ijobiy Babinskiy simptomi, chuqur sezuvchanlik buzilishi, paresteziya, ataksiya, paraplegiya va motor kasalliklari bilan psevdotabetik kasalliklar (zarar belgilari). orqa miya va piramidal yo'lning orqa ustunlari).
Qondagi eng tipik o'zgarishlar. Eritrositlar soni odatda keskin kamayadi, 1-2 milliongacha va undan past bo'ladi. Gemoglobin miqdori ham keskin pasayadi, ba'zan 10% gacha. Rang indeksi ba'zi hollarda past, ba'zan me'yorga yaqin, ba'zan esa yuqori (ayniqsa, og'ir anemiya bilan). Anizositoz va poykilotsitoz, bazofil ponksiyon va yadro eritrotsitlarining paydo bo'lishi, retikulotsitlar sonining va eritrotsitlar hajmining ko'payishi qayd etilgan. Leykotsitlar sonining keskin kamayishi ko'proq xarakterlidir. Ba'zida dastlab leykotsitoz, tezda leykopeniya bilan almashtiriladi, ESR tezlashadi. Qondagi o'zgarishlar bir vaqtning o'zida rivojlanmaydi. Ko'pincha leykopoetik tizim oldinroq ta'sirlanadi, keyinchalik trombotsitopeniya qo'shiladi. Eritroblastik funktsiyaning mag'lubiyati ko'pincha keyinchalik ham sodir bo'ladi. Kelajakda og'ir zaharlanishning xarakterli surati rivojlanishi mumkin - aplastik anemiya.
Zaharlanish oqibatlari benzol bilan ishlashni to'xtatgandan keyin ham davom etishi va hatto oylar va yillar davomida rivojlanishi mumkin.
Zaharlanish va davolash uchun birinchi yordam
Benzol (benzol bug'i) bilan o'tkir zaharlanishda jabrlanuvchini birinchi navbatda toza havoga olib chiqish kerak, nafas olish to'xtatilganda, normalizatsiya qilish uchun sun'iy nafas olish amalga oshiriladi, nafas olish stimulyatorlari sifatida kislorod va lobelin qo'llaniladi. Adrenalinni analeptik sifatida ishlatish qat'iyan man etiladi! Agar qusish bo'lsa, tomir ichiga 40% glyukoza eritmasi, qon aylanishining buzilishida - kofein eritmasi yuboriladi. Agar zaharlanish og'iz orqali sodir bo'lsa va benzol oshqozonga tushsa, uni o'simlik moyi bilan yuvish kerak (benzol yaxshi so'riladi), protsedurani ehtiyotkorlik bilan bajarish kerak, chunki aspiratsiya mumkin. Engil zaharlanish bilan bemorga dam olish ko'rsatiladi. Hayajonlangan holatlarda sedativlar kerak. Anemiya, qon quyish, B12 vitamini, foliy kislotasi, leykopeniya bo'lsa - vitamin B6, pentoksil o'tkaziladi. Immunitetning pasayishi (immunitet tanqisligi holati) bo'lsa - immunostimulyatorlar.
Benzolning biomembranlarga ta'siri
Biologik membranalar supramolekulyar tuzilmalar - qo'sh lipidli qatlam bo'lib, ular ichiga oqsillar, polisaxaridlar molekulalari yuzasida birlashtirilgan (ko'milgan) yoki biriktirilgan. Biomembranlarni tashkil etuvchi lipidlar o'z tabiatiga ko'ra amfifil (amofil) birikmalardir, ya'ni ularda qutbli guruhlar mavjudligi sababli ham qutbli, ham qutbsiz moddalarda erishi mumkin. "bosh"(karboksilik -COOH, gidroksil -OH, aminokislotalar -NH 2 va boshqalar) va qutbsiz deb ataladi. "dumlar"(uglevodorod radikallari - alkillar, arillar, xolestan kabi polisiklik tuzilmalar va boshqalar).
Benzol biologik membranalarning samarali erituvchisi bo'lib, qutbsiz guruhlarni (uglevodorod deb ataladigan) tezda eritib yuboradi. "dumlar") lipidlar, asosan, membranalarning bir qismi bo'lgan xolesterin. Eritish jarayoni benzolning kontsentratsiyasi bilan chegaralanadi, u qanchalik ko'p bo'lsa, bu jarayon tezroq ketadi. Eritish jarayonida energiya ajralib chiqadi, tom ma'noda qo'sh lipid qatlamini (lipid ikki qavati) buzadi, bu membrananing to'liq yo'q qilinishiga (tuzilmasining buzilishi) va keyinchalik hujayra apoptoziga olib keladi (biomembranalarni yo'q qilish paytida membrana retseptorlari faollashadi (bunday). kabi: CD95, TNFR1, DR3, DR4 va boshqalar) hujayra apoptozini faollashtiradi).
Teri ustidagi harakat
Qo'llarning benzol bilan tez-tez aloqa qilishida quruq teri, yoriqlar, qichishish, qizarish (odatda barmoqlar orasida), shish, tariq kabi pufakchalar toshmalari kuzatiladi. Ba'zida terining shikastlanishi tufayli ishchilar o'z ishlarini tark etishga majbur bo'lishadi.
Maksimal ruxsat etilgan kontsentratsiya 5 mg / m 3 ni tashkil qiladi.
Xavfsizlik
Benzol bilan ishlash zaharlanish va jiddiy sog'liq muammolari xavfini keltirib chiqaradi. Benzol juda uchuvchan suyuqlik (20°C da uchuvchanligi 320 mg/l) yuqori daraja ateşleme, shuning uchun u bilan ishlashda yonuvchan suyuqliklar bilan ishlashda xavfsizlik choralariga rioya qilish kerak. Benzol bug'lari katta xavf tug'diradi, chunki ular havo bilan portlovchi aralashmalar hosil qilishi mumkin. Hozirgi vaqtda benzolni organik erituvchi sifatida ishlatish uning bug'larining toksikligi va kanserogen ta'siri va teriga salbiy ta'siri tufayli jiddiy cheklangan. Laboratoriyalarda benzol bilan ishlash uning cheklanishini ham ta'minlaydi (qat'iy tartibga solinadi). Benzolni tajribalarda faqat kichik hajmlarda (50 ml dan ko'p bo'lmagan) qo'llash tavsiya etiladi, ish faqat flororezina qo'lqoplar bilan amalga oshirilishi kerak (lateks benzol ta'sirida eriydi va shishadi).
- issiqlik manbalari, ochiq olov yaqinida saqlang; kuchli oksidlovchilar, oziq-ovqat mahsulotlari va boshqalar,
- tarkibida benzol bo'lgan idishlarni ochiq qoldiring, tutun;
- oziq-ovqat mahsulotlarini ishlatish, qo'llarni yuvish, idishlarni yuvish uchun benzol idishlaridan foydalaning,
- havo harorati 30 ° C dan yuqori bo'lgan yopiq, yomon havalandırılan xonada ishlash;
- hal qiluvchi sifatida katta hajmdagi moddadan foydalaning,
- qo'l terisi, ko'z va nafas olish organlari uchun himoya vositalarisiz ishlash.
Ekologiya
Benzol ekologik jihatdan xavfli modda, antropogen kelib chiqishi toksikantidir. Benzolning asosiy manbalari muhit co kanalizatsiya yoki havo emissiyasi neft-kimyo va koks sanoati, yoqilg'i ishlab chiqarish va transportdir. Suv omborlaridan benzol osongina uchib ketadi, tuproqdan o'simliklarga aylanishga qodir, bu esa ekotizimlarga jiddiy xavf tug'diradi.
Benzol to'planish xususiyatiga ega, lipofilligi tufayli hayvonlarning yog 'to'qimalari hujayralarida to'planishi va shu bilan ularni zaharlashi mumkin.
PRTSVSH (F) FGBOU VPO
“Yong‘in xavfsizligi” kafedrasi
Nazorat ishi
“Yonish va portlashlar nazariyasi” fanidan
Vazifa raqami 1
Benzol bug'ining to'liq yonishi uchun zarur bo'lgan havoning o'ziga xos nazariy miqdori va hajmini aniqlang. Havoning joylashgan sharoitlari harorat Tv va bosim Pv va benzol bug'i - harorat Tg va bosim Pg bilan tavsiflanadi. Hisoblash natijalarini quyidagi birliklarda ifodalang: ; ;;;
Dastlabki ma'lumotlar (N - guruh raqami, n - talabalar ro'yxati bo'yicha raqam:
TV=300+(-1) N *2*N-(-1) n *0,2*n= 277,6 K
Pv \u003d?10 3 \u003d 95900 Pa;
Tg=300?(?1) N?2?N?(?1) n?0,2?n= 321,6 K;
Pr \u003d? 10 3 \u003d 79400 Pa.
S6N6+7,5O2+7,5?3,76N2=6CO2+3pO+7,5?3,76N2+Qp (1),
Bu erda Qp - kimyoviy reaksiyaning issiqligi. Kimdan berilgan tenglama benzol va molekulyar kislorodning stexiometrik koeffitsientlarini aniqlash mumkin: Vg = 1, V0 = 7,5
2. Havoning o'ziga xos nazariy miqdori - bir kilomol benzolning to'liq yonishi uchun zarur bo'lgan havoning kilomol soni quyidagi formula bo'yicha hisoblanadi:
bu erda 4,76 - kislorod birligini o'z ichiga olgan havo miqdori, \u003d molekulyar kislorod (Vo) va benzol (Vg) ning stokiometrik koeffitsientlarining nisbati.
(d) dagi Vo va Vg qiymatlarini almashtirib, biz quyidagilarni olamiz:
3. Bir kilomol benzolning to‘liq yonishi uchun zarur bo‘lgan havo hajmi quyidagicha aniqlanadi:
bu erda bir kilomol havoning hajmi Tv haroratda va Pv bosimida. Qiymat formuladan foydalanib hisoblanadi
Bu erda 22,4 - normal sharoitda gazning molyar hajmi, Po = 101325 Pa - normal bosim, To = 273 K - normal harorat.
(5) dagi Tv, To, Pv, Po ni almashtirsak, biz hosil qilamiz
Maxsus nazariy havo hajmi formula (4) bo'yicha hisoblanadi:
4. Gazsimon yoqilg'ining birlik hajmini to'liq yoqish uchun zarur bo'lgan havo hajmi quyidagicha aniqlanadi:
bu erda bir kilomol yoqilg'ining hajmi - benzol bug'i haroratda Tg va bosim Pg. Sharti bilan; inobatga olgan holda
va (8) va (5) ni (7) ga almashtirsak, biz aniq nazariy havo hajmi uchun quyidagi ifodani olamiz:
Biz yonish jarayonining ushbu parametrining qiymatini hisoblaymiz:
Bir kilogramm benzolni to'liq yoqish uchun zarur bo'lgan havo hajmi quyidagicha aniqlanadi:
bu erda - yoqilg'ining molyar massasi kilogrammda ifodalangan bir kilomol benzolning massasi. Benzolning molyar massasi son jihatdan uning molekulyar og'irligiga teng bo'lgan formula bilan topiladi:
Ac?nc + An?nn, UiAi?ni (11)
Bu erda Ac va An uglerod va vodorodning atom og'irliklari, nc va nn - benzol molekulasidagi uglerod atomlarining soni. Ac = 12, nc = 6, An = 1, nn = 6 qiymatlarini almashtirsak, biz quyidagilarni olamiz:
Biz havoning o'ziga xos nazariy hajmini n ning qiymatlarini formulaga (10) almashtirish orqali topamiz:
Hisoblash natijasi:
Vazifa raqami 2
Benzol yonish mahsulotlarining ortiqcha havo koeffitsienti c, harorat Tp va yonish mahsulotlarining bosimi Pp, benzol bug'ining harorati Tg va bosimi Pg ma'lum bo'lsa, uning solishtirma nazariy miqdori, hajmi va tarkibini aniqlang. Hisoblash natijalarini mol kasrlarida (foizda) va quyidagi birliklarda ifodalang: ; ;;
Dastlabki ma'lumotlar:
c=1,5+(?1) N?0,1?N?(?1) n?0,01?n = 0,2;
Rp \u003d?10 3 \u003d 68400 Pa;
Tp=1600?(?1) N?20?N?(?1) n?2?n = 1816 K;
Tg=273?(?1) N?2?N+(?1) n?0,2?n = 295,4 K;
Rg \u003d?10 3 \u003d 111600 Pa;
eritma (N=11, n=2).
1. Benzolning havoda yonishi reaksiyasining stexiometrik tenglamasini yozamiz:
C 6 H 6 +7,5O 2 +7,5? 3,76N 2 \u003d 6CO 2 + 3H 2 O + 7,5? 3,76N 2 + Qp, (1)
Bu erda Qp - kimyoviy reaksiyaning issiqligi. Ushbu tenglamadan biz quyidagi stokiometrik koeffitsientlarni aniqlaymiz:
V CO2 \u003d 6, V pO \u003d 3, V C6H6 \u003d 1, V O2 \u003d 7,5, V N2 \u003d 7,5? 3,76
2. Bir kilomol yoqilg'ining yonish mahsulotining taxminiy miqdorini aniqlang:
(2) dagi yonish mahsulotlari va yoqilg'ining stexiometrik koeffitsientlari qiymatlarini almashtirib, biz quyidagilarni olamiz:
3. Havoning o'ziga xos nazariy miqdori - bir kilomol yoqilg'ining to'liq yonishi uchun zarur bo'lgan havoning kilomol miqdorini formuladan foydalanib aniqlaymiz:
Bu erda 4,76 - kislorod birligini o'z ichiga olgan havo miqdori,
Molekulyar kislorod va benzolning stexiometrik koeffitsientlari nisbati.
(4) dagi V O2 =7,5 va V C6H6 =1 qiymatlarini almashtirib, biz quyidagilarni olamiz:
4. 1 Kmol yoqilg'iga tushadigan ortiqcha havo miqdori quyidagi ifoda bilan aniqlanadi:
benzol bug'ining yonish havosi
Ushbu ifodadagi qiymatlarni almashtirish
37,7(0,2-1)=30,16(7)
5. Yonilg'i moddasining birlik miqdoridagi yonish mahsulotlarining umumiy miqdori yig'indisi bilan aniqlanadi:
Qiymatlarni almashtirgandan so'ng va biz quyidagilarni olamiz:
6. Foizda ifodalangan yonish mahsulotlarining mol ulushlari quyidagicha aniqlanadi:
Yonish mahsulotlaridagi azot va kislorodning mol ulushlari uchun (9) formulalarda 0,79 va 0,21 bu moddalarning havodagi mol ulushlari bo'lib, ularning ortishi azot ulushining oshishiga va kislorod paydo bo'lishiga olib keladi. yonish mahsulotlarida.
7. Muayyan hajmlar va yonish mahsulotlarini aniqlash uchun ularning molyar hajmini - mahsulotlar joylashgan sharoitda bir kilomol gaz hajmini hisoblash kerak:
bu erda 22,4 - normal sharoitda bir kilomol gaz hajmi, T 0 \u003d 273K - normal harorat, Po \u003d 101325 Pa - normal bosim.
(10) dagi Po, To qiymatlarini almashtirsak, biz quyidagilarni olamiz:
Ortiqcha havoni hisobga olmaganda, bir kilogramm yoqilg'ining yonishi natijasida hosil bo'ladigan mahsulotlar hajmi quyidagicha hisoblanadi:
bu erda - yoqilg'ining molyar massasi kilogrammda ifodalangan bir kilomol benzolning massasi. Benzolning molyar massasi quyidagi formula bo'yicha topiladi:
Bu erda Ac va An - uglerod (12) va vodorod (1) ning atom og'irliklari, n c va n n - benzol molekulalaridagi uglerod (6) va vodorod (6) atomlarining soni (C 6 H 6).
Qiymatlarni almashtirib, (12) da olamiz
1 kilogramm yoqilg'i uchun ortiqcha havo miqdori quyidagicha aniqlanadi:
bu erda yonish mahsulotlarining bir qismi bo'lgan bir kilomol ortiqcha havo hajmi. Haddan tashqari havo harorati va bosimi yonish mahsulotlarining harorati va bosimiga to'g'ri kelganligi sababli, u holda \u003d \u003d 220,7.
Ushbu qiymatni (14) o'rniga qo'yib, biz quyidagilarni olamiz:
Yoqilg'ining to'liq yonishi mahsulotining o'ziga xos hajmini hisoblash uchun biz benzin bug'ining bosim ostida Tg haroratiga ega deb hisoblaymiz:
bu yerda Tg haroratda va Pg bosimida bir kilomol benzol bug'ining hajmi. Yoqilg'ining molyar hajmi quyidagi formula bo'yicha hisoblanadi:
Olingan qiymatni va (17) dagi bunday qiymatlarni almashtirib, biz quyidagilarni olamiz:
Har bir kishi uchun ortiqcha havo miqdori kubometr benzol bug'i quyidagicha aniqlanadi:
(20) qiymatlarda almashtirish \u003d 30,16 , \u003d va
quyidagi natijani beradi:
Ortiqcha havoni hisobga olgan holda yonish mahsulotlarining umumiy o'ziga xos hajmi yig'indisi bilan aniqlanadi
Hisoblash natijasi:
X CO2 \u003d%; X H2O \u003d 4,4%; X N2 =%; X O2 \u003d 11,7%
Shunga o'xshash hujjatlar
Nitrobenzol C6H5NO2 va uglerod disulfidi CS2 ning yonish koeffitsientini hisoblash. Propil asetatning havoda yonish reaksiyasi tenglamasi. Yonuvchan gazni yoqish paytida havo va yonish mahsulotlarining hajmini hisoblash. V. Blinov formulasi bo'yicha toluolning porlash nuqtasini aniqlash.
test, 04/08/2017 qo'shilgan
Moddaning yonishi paytida hosil bo'lgan havo va yonish mahsulotlarining hajmini hisoblash. Etilen glikolning havoda yonish reaksiyasi tenglamasi. Yonuvchan gazlar aralashmasining yonishi. Stokiometrik aralashma uchun adiabatik yonish haroratini hisoblash. propanolning yonishi.
test, 10/17/2012 qo'shilgan
Yonish turi va uning asosiy parametrlari. Yonilg'i va oksidantning yonish mahsulotlariga kimyoviy aylanishi. Yonish reaksiyasining moddiy va issiqlik balansi tenglamalari. Haddan tashqari havo koeffitsientining yonish mahsulotlarining tarkibiga va yonish haroratiga ta'siri.
test, 2013-01-17 qo'shilgan
Yonuvchan moddaning birlik massasini to'liq yoqish uchun zarur bo'lgan havo hajmini aniqlash. Yonuvchan moddaning birlik massasining yonish mahsulotlarining tarkibi. Gaz, bug ', chang-havo aralashmalarining olov tarqalishi chegaralari. Portlovchi parchalanish bosimi.
muddatli ish, 23.12.2013 yil qo'shilgan
Yong'in va portlashlarning paydo bo'lishining oldini olish bo'yicha chora-tadbirlarni ishlab chiqish, ularning rivojlanishi va bartaraf etish shartlarini baholash. Kuchlanish darajasi tushunchasi, uni aniqlash usuli. Yonish reaksiyasi tenglamasini tuzish tartibi. Olovni yoqish uchun zarur bo'lgan havo hajmini hisoblash.
muddatli ish, 07/10/2014 qo'shilgan
Gazning to'liq yonishi mahsulotlarining tarkibini aniqlash. Doimiy hajm va doimiy bosimda gaz aralashmasining adiabatik yonish haroratini hisoblash. Tabiiy gazning o'z-o'zidan yonishi kinetik reaksiya konstantalari. Gaz aralashmasining yonish chegarasi.
muddatli ish, 2014-02-19 qo'shilgan
Benzolni propilen bilan alkillashning sanoat usullarini tavsiflash. Kimyoviy texnologiyada benzolni olefinlar bilan alkillash tamoyillari. Benzolni alkillash uchun texnologik qurilmalarni loyihalash muammolari. Ishlab chiqarish jarayoni texnologiyasining tavsifi.
dissertatsiya, 11/15/2010 qo'shilgan
Yonish kuchli oksidlanish jarayonidir. Yonish turlari: yonish va olov bilan yonish. Yonishning maxsus holati sifatida portlash. Olovning elektr xossalari. Yoqilg'ining to'liq yonmasligi natijasida yonish mahsulotlarining xilma-xilligi. Tutunni suv orqali filtrlash.
ilmiy ish, 29.07.2009 yil qo'shilgan
Berilgan miqdordagi propanning to'liq yonishi uchun zarur bo'lgan havo hajmini aniqlash. Gess qonunining oqibatlaridan foydalanib, entalpiya, entropiya va Gibbs energiyasining o'zgarishini hisoblash. Oksidlovchi va qaytaruvchi moddaning molyar massasi ekvivalentlarini aniqlash.
test, 02/08/2012 qo'shilgan
Absorbent moy sarfini, absorbentdan chiqib ketayotgan changni yutish moydagi benzol konsentratsiyasini aniqlash usullari. Qadoqlangan absorberning diametri va balandligini hisoblash. Ustunning kubida kerakli isitish sirtini va isitish bug'ining sarfini aniqlash.
Sizning e'tiboringizga mavzu bo'yicha video darslikni taqdim etamiz " Kimyoviy xossalari Benzol". Ushbu videodan foydalanib, siz benzolning kimyoviy xossalari, shuningdek, benzolning boshqa moddalar bilan reaksiyaga kirishishi uchun zarur bo'lgan og'ir sharoitlar haqida tasavvurga ega bo'lishingiz mumkin.
Mavzu:aromatik uglevodorodlar
Dars:Benzolning kimyoviy xossalari
Guruch. 1. Benzol molekulasi
Benzol molekulasidagi p-elektron bulutini sindirish qiyin. Shuning uchun, benzol kimyoviy reaktsiyalarga to'yinmagan birikmalarga qaraganda kamroq faol kiradi.


Benzolning kimyoviy reaktsiyalarga kirishi uchun juda og'ir sharoitlar kerak: yuqori harorat va ko'p hollarda katalizator. Aksariyat reaksiyalarda barqaror benzol halqasi saqlanib qoladi.
1. Bromlanish.

Katalizator (temir (III) yoki alyuminiy bromid) talab qilinadi va hatto kichik miqdordagi suvning kirishiga yo'l qo'ymaslik kerak. Katalizatorning roli shundaki, brom molekulasi brom atomlaridan biri tomonidan temir atomiga tortiladi. Natijada, u qutblanadi - temir bilan bog'langan brom atomiga bir juft bog'langan elektron o'tadi:
Br+…. Br - fevral 3.
Br+ kuchli elektrofildir. U benzol halqasining olti elektronli bulutiga tortiladi va uni buzadi, hosil qiladi kovalent bog'lanish uglerod atomi bilan:
Brom anioni hosil bo'lgan kationga qo'shilishi mumkin edi. Ammo benzol halqasining aromatik tizimining qisqarishi energetik jihatdan brom anionining qo'shilishidan ko'ra qulayroqdir. Shuning uchun molekula vodorod ionini chiqarib tashlash orqali barqaror holatga o'tadi:
Benzol halqasidagi barcha elektrofil almashtirish reaktsiyalari xuddi shunday mexanizm bo'yicha boradi.
2. Nitrlash

Benzol va uning gomologlari konsentrlangan sulfat va nitrat kislotalar aralashmasi (nitratlovchi aralashma) bilan reaksiyaga kirishadi. Nitratlovchi aralashmada, muvozanat holatida, elektrofil bo'lgan nitron ioni NO 2 + mavjud:

3. Sulfonatsiya.
Benzol va boshqa arenlar qizdirilganda konsentrlangan sulfat kislota yoki oleum - SO 3 ning sulfat kislotadagi eritmasi bilan reaksiyaga kirishadi:

4 . Friedel-Crafts alkilatsiyasi
5. Alkenlar bilan alkillanish

Bu reaktsiyalar energetik jihatdan noqulaydir, shuning uchun ular faqat qizdirilganda yoki nurlanganda davom etadi.
1. Gidrogenlash.
Qizdirilganda, yuqori bosimda va Ni, Pt yoki Pd katalizatori ishtirokida, benzol va boshqa arenlar siklogeksanni hosil qilish uchun vodorod qo'shadi:

2. Benzolni xlorlash.
Ultraviyole nurlanish ta'sirida benzol xlor qo'shadi. Agar benzoldagi xlor eritmasi solingan kvarts shisha kolbaga quyosh nuri tushsa, eritma tezda rangi o‘zgaradi, xlor benzol bilan qo‘shilib 1,2,3,4,5,6-geksaxlorotsiklogeksan hosil qiladi. geksaxloran(ilgari insektitsid sifatida ishlatilgan):

3. yonayotgan benzol.
Alkanlardan farqli o'laroq, benzol va boshqa aromatik uglevodorodlarning alangasi yorqin va tutunli.
Darsni yakunlash
Ushbu darsda siz "Benzolning kimyoviy xossalari" mavzusini o'rgandingiz. Ushbu materialdan foydalanib, siz benzolning kimyoviy xossalari, shuningdek, benzolning boshqa moddalar bilan reaksiyaga kirishishi uchun zarur bo'lgan og'ir sharoitlar haqida tasavvurga ega bo'ldingiz.
Adabiyotlar ro'yxati
1. Rudzitis G.E. Kimyo. Asoslar umumiy kimyo. 10-sinf: darslik ta'lim muassasalari: asosiy daraja / G. E. Rudzitis, F.G. Feldman. - 14-nashr. - M.: Ta'lim, 2012.
2. Kimyo. 10-sinf. Profil darajasi: darslik. umumiy ta'lim uchun muassasalar / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin va boshqalar - M .: Drofa, 2008. - 463 p.
3. Kimyo. 11-sinf. Profil darajasi: darslik. umumiy ta'lim uchun muassasalar / V.V. Eremin, N.E. Kuzmenko, V.V. Lunin va boshqalar - M .: Drofa, 2010. - 462 p.
4. Xomchenko G.P., Xomchenko I.G. Universitetlarga kiruvchilar uchun kimyo fanidan masalalar to'plami. - 4-nashr. - M .: RIA "Yangi to'lqin": Nashriyotchi Umerenkov, 2012. - 278 p.
Uy vazifasi
1. No 13, 14 (62-bet) Rudzitis G.E., Feldman F.G. Kimyo: Organik kimyo. 10-sinf: ta'lim muassasalari uchun darslik: asosiy daraja / G. E. Rudzitis, F.G. Feldman. - 14-nashr. - M.: Ta'lim, 2012.
2. Nima uchun aromatik birikmalar kimyoviy xossalari bo‘yicha to‘yingan va to‘yinmagan uglevodorodlardan farq qiladi?
3. Etilbenzol va ksilenning yonish reaksiyalari tenglamalarini yozing.
TA’RIF
Benzol(siklogeksatrien - 1,3,5) - organik moddalar, bir qator aromatik uglevodorodlarning eng oddiy vakili.
Formula - C 6 H 6 (tuzilish formulasi - 1-rasm). Molekulyar massa – 78, 11.
Guruch. 1. Benzolning strukturaviy va fazoviy formulalari.
Benzol molekulasidagi barcha oltita uglerod atomi sp 2 gibrid holatidadir. Har bir uglerod atomi boshqa ikkita uglerod atomi va bitta tekislikda joylashgan bitta vodorod atomi bilan 3s bog' hosil qiladi. Oltita uglerod atomi muntazam olti burchakli (benzol molekulasining s-skeleti) hosil qiladi. Har bir uglerod atomida bitta gibridlanmagan p-orbital mavjud bo'lib, unda bitta elektron mavjud. Oltita p-elektron bitta p-elektron bulutini (aromatik tizim) hosil qiladi, u olti a'zoli tsikl ichidagi doira shaklida tasvirlangan. Benzoldan olingan uglevodorod radikali C 6 H 5 - - fenil (Ph-) deb ataladi.
Benzolning kimyoviy xossalari
Benzol elektrofil mexanizmga muvofiq sodir bo'ladigan almashtirish reaktsiyalari bilan tavsiflanadi:
- galogenlanish (benzol katalizatorlar ishtirokida xlor va brom bilan o'zaro ta'sir qiladi - suvsiz AlCl 3, FeCl 3, AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- nitrlash (benzol nitratlovchi aralashma bilan oson reaksiyaga kirishadi - konsentrlangan nitrat va sulfat kislotalar aralashmasi)

- alkenlar bilan alkillanish
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2;
Benzolga qo'shilish reaktsiyalari aromatik tizimning yo'q qilinishiga olib keladi va faqat og'ir sharoitlarda davom etadi:
- gidrogenlash (reaksiya qizdirilganda davom etadi, katalizator Pt dir)

- xlor qo'shilishi (UV nurlanishi ta'sirida qattiq mahsulot - geksaxlorotsiklogeksan (geksaxloran) - C 6 H 6 Cl 6 hosil bo'lishi bilan yuzaga keladi)

Har qanday kabi organik birikma benzol reaktsiya mahsuloti sifatida hosil bo'lishi bilan yonish reaktsiyasiga kiradi karbonat angidrid va suv (tutunli olov bilan yonadi):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
Benzolning fizik xossalari
Benzol rangsiz suyuqlikdir, lekin o'ziga xos o'tkir hidga ega. Suv bilan azeotrop aralashma hosil qiladi, efirlar, benzin va turli organik erituvchilar bilan yaxshi aralashadi. Qaynash harorati - 80,1C, erish nuqtasi - 5,5C. Toksik, kanserogen (ya'ni saraton rivojlanishiga hissa qo'shadi).
Benzolni olish va ishlatish
Benzolni olishning asosiy usullari:
— geksanning degidrotsikllanishi (katalizatorlar - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2;
- siklogeksanning gidrogenlanishi (reaksiya qizdirilganda davom etadi, katalizator Pt dir)
C 6 H 12 → C 6 H 6 + 4H 2;
- asetilenning trimerizatsiyasi (reaksiya 600C ga qizdirilganda davom etadi, katalizator faollashgan ugleroddir)
3HC≡CH → C 6 H 6.
Benzol gomologlar (etilbenzol, kumen), siklogeksan, nitrobenzol, xlorbenzol va boshqa moddalarni olish uchun xom ashyo sifatida xizmat qiladi. Ilgari, benzinning oktan sonini oshirish uchun benzinga qo'shimcha sifatida benzin ishlatilgan bo'lsa, hozirda uning yuqori toksikligi tufayli yoqilg'i tarkibidagi benzolning tarkibi qat'iy tartibga solinadi. Ba'zida benzol erituvchi sifatida ishlatiladi.
Muammoni hal qilishga misollar
MISOL 1
| Vazifa | Quyidagi o'zgarishlarni amalga oshirish mumkin bo'lgan tenglamalarni yozing: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Yechim | Metandan asetilen olish uchun quyidagi reaksiyadan foydalaniladi: 2CH 4 → C 2 H 2 + 3H 2 (t = 1400C). Asetilendan benzolni olish asetilenning trimerizatsiya reaktsiyasi orqali mumkin, bu qizdirilganda (t = 600C) va faol uglerod ishtirokida sodir bo'ladi: 3C 2 H 2 → C 6 H 6. Mahsulot sifatida xlorbenzol olish uchun benzolni xlorlash reaksiyasi temir (III) xlorid ishtirokida amalga oshiriladi: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
2-MISA
| Vazifa | 39 g benzolga temir (III) xlorid ishtirokida 1 mol bromli suv qo'shildi. Bu moddaning qancha miqdori va qancha gramm qanday mahsulotlarga olib keldi? |
| Yechim | Temir (III) xlorid ishtirokidagi benzolning bromlanish reaksiyasi tenglamasini yozamiz: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Reaksiya mahsulotlari bromobenzol va vodorod bromiddir. Jadval yordamida hisoblangan benzolning molyar massasi kimyoviy elementlar DI. Mendeleyev - 78 g/mol. Benzol moddasining miqdorini toping: n (C 6 H 6) = m (C 6 H 6) / M (C 6 H 6); n (C 6 H 6) = 39/78 = 0,5 mol. Muammoning shartiga ko'ra, benzol 1 mol brom bilan reaksiyaga kirishdi. Binobarin, benzol yetishmaydi va benzol uchun keyingi hisob-kitoblar amalga oshiriladi. Reaksiya tenglamasiga ko'ra n (C 6 H 6): n (C 6 H 5 Br) : n (HBr) \u003d 1: 1: 1, shuning uchun n (C 6 H 6) \u003d n (C 6 H 5) Br) \u003d: n(HBr) = 0,5 mol. Keyin bromobenzol va vodorod bromidning massalari teng bo'ladi: m (C 6 H 5 Br) = n (C 6 H 5 Br) × M (C 6 H 5 Br); m(HBr) = n(HBr)×M(HBr). D.I. kimyoviy elementlar jadvali yordamida hisoblangan bromobenzol va vodorod bromidning molyar massalari. Mendeleyev - mos ravishda 157 va 81 g / mol. m (C 6 H 5 Br) = 0,5 × 157 = 78,5 g; m (HBr) = 0,5 x 81 = 40,5 g. |
| Javob | Reaksiya mahsulotlari bromobenzol va vodorod bromiddir. Bromobenzol va vodorod bromidning massalari mos ravishda 78,5 va 40,5 g. |
Reaksiyalarning birinchi guruhi o'rin almashish reaktsiyalaridir. Biz aytdikki, arenlar molekulyar tuzilishda bir nechta bog'larga ega emas, lekin oltita elektrondan iborat konjugatsiyalangan tizimni o'z ichiga oladi, bu juda barqaror va benzol halqasiga qo'shimcha kuch beradi. Shuning uchun, in kimyoviy reaksiyalar vodorod atomlarini almashtirish birinchi bo'lib, benzol halqasini yo'q qilish emas.
Alkanlar haqida gapirganda, biz allaqachon almashtirish reaktsiyalariga duch kelganmiz, ammo ular uchun bu reaktsiyalar radikal mexanizm bo'yicha ketayotgan bo'lsa, arenlar o'rin almashish reaktsiyalarining ion mexanizmi bilan tavsiflanadi.
Birinchidan kimyoviy xossasi - galogenlanish. Vodorod atomini halogen atomiga almashtirish - xlor yoki brom.
Reaksiya qizdirilganda va har doim katalizator ishtirokida davom etadi. Xlor bo'lsa, u alyuminiy xlorid yoki temir xlorid uchta bo'lishi mumkin. Katalizator galogen molekulasini qutblantiradi, natijada geterolitik aloqa uziladi va ionlar olinadi.
Ijobiy zaryadlangan xlorid ioni benzol bilan reaksiyaga kirishadi.
Agar reaksiya brom bilan sodir bo'lsa, u holda temir tribromid yoki alyuminiy bromid katalizator sifatida ishlaydi.

Shuni ta'kidlash kerakki, reaktsiya bromli suv bilan emas, balki molekulyar brom bilan sodir bo'ladi. Benzol bromli suv bilan reaksiyaga kirishmaydi.
Benzol gomologlarini galogenlash o'ziga xos xususiyatlarga ega. Toluol molekulasida metil guruhi halqadagi almashtirishni osonlashtiradi, reaktivlik kuchayadi va reaktsiya engilroq sharoitlarda, ya'ni xona haroratida davom etadi.

Shuni ta'kidlash kerakki, almashtirish har doim orto va para pozitsiyalarida sodir bo'ladi, shuning uchun izomerlar aralashmasi olinadi.
Ikkinchi xossasi - benzolning nitrlanishi, benzol halqasiga nitroguruhning kiritilishi.

Achchiq bodom hidi bo'lgan og'ir sarg'ish suyuqlik - nitrobenzol hosil bo'ladi, shuning uchun reaksiya benzol uchun sifatli bo'lishi mumkin. Nitrlash uchun konsentrlangan nitrat va sulfat kislotalarning nitratlovchi aralashmasi ishlatiladi. Reaktsiya isitish orqali amalga oshiriladi.
Eslatib o'taman, Konovalov reaksiyasida alkanlarni nitrlash uchun sulfat kislota qo'shmasdan suyultirilgan nitrat kislota ishlatilgan.
Toluolni nitrlashda, shuningdek, galogenlashda orto- va para-izomerlar aralashmasi hosil bo'ladi.

Uchinchi xossasi - benzolni galolalkanlar bilan alkillash.

Bu reaksiya benzol halqasiga uglevodorod radikalini kiritish imkonini beradi va benzol gomologlarini olish usuli sifatida qaralishi mumkin. Alyuminiy xlorid katalizator sifatida ishlatiladi, bu haloalkan molekulasining ionlarga parchalanishiga yordam beradi. Bundan tashqari, isitish kerak.
To'rtinchi xossasi - benzolni alkenlar bilan alkillash.

Shu tarzda, masalan, kumen yoki etilbenzol olish mumkin. Katalizator alyuminiy xloriddir.
2. Benzolga qo'shilish reaksiyalari
Reaksiyalarning ikkinchi guruhi qo'shilish reaktsiyalaridir. Biz bu reaktsiyalar xarakterli emasligini aytdik, lekin ular pi-elektron bulutining yo'q qilinishi va olti sigma aloqalarining shakllanishi bilan juda og'ir sharoitlarda mumkin.
Beshinchi umumiy ro'yxatdagi xususiyat - gidrogenlash, vodorod qo'shilishi.
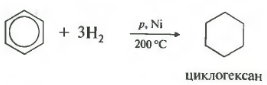
Harorat, bosim, katalizator nikel yoki platina. Toluol ham xuddi shunday reaksiyaga kirisha oladi.
oltinchi xususiyati - xlorlash. E'tibor bering, biz xlor bilan o'zaro ta'sir haqida gapiramiz, chunki brom bu reaktsiyaga kirmaydi.

Reaktsiya qattiq ultrabinafsha nurlanish ostida davom etadi. Geksaxloranning boshqa nomi geksaxlorotsiklogeksan, qattiq modda hosil bo'ladi.
Benzol uchun buni eslash muhim mumkin emas vodorod galogenidlarining qo'shilish reaktsiyalari (gidrogalogenlash) va suv qo'shilishi (gidratlanish).
3. Benzol gomologlarining yon zanjirida almashinish
Reaktsiyalarning uchinchi guruhi faqat benzol gomologlariga tegishli - bu yon zanjirdagi almashtirish.
yettinchi umumiy ro'yxatdagi xususiyat yon zanjirdagi alfa uglerod atomida galogenlanishdir.

Reaktsiya qizdirilganda yoki nurlanganda va har doim faqat alfa-uglerodda sodir bo'ladi. Galogenlanish davom etar ekan, ikkinchi halogen atomi alfa holatiga qaytadi.
4. Benzol gomologlarining oksidlanishi
Reaksiyalarning to'rtinchi guruhi - oksidlanish.
Benzol halqasi juda kuchli, shuning uchun benzol oksidlanmaydi kaliy permanganat - uning eritmasini rangsizlantirmaydi. Buni eslash juda muhim.
Boshqa tomondan, benzol gomologlari qizdirilganda kaliy permanganatning kislotali eritmasi bilan oksidlanadi. Va bu sakkizinchi kimyoviy xususiyatdir.

Bu benzoy kislotasi bo'lib chiqadi. Eritmaning rangsizlanishi kuzatiladi. Bunday holda, o'rinbosarning uglerod zanjiri qancha uzun bo'lishidan qat'i nazar, u birinchi uglerod atomidan keyin doimo uziladi va alfa atomi benzoik kislota hosil bo'lishi bilan karboksil guruhiga oksidlanadi. Molekulaning qolgan qismi tegishli kislotaga yoki agar u faqat bitta uglerod atomi bo'lsa, karbonat angidridga oksidlanadi.
Agar benzol gomologida aromatik halqada bir nechta uglevodorod o'rnini bosuvchi bo'lsa, u holda oksidlanish bir xil qoidalarga muvofiq sodir bo'ladi - alfa holatidagi uglerod oksidlanadi.

Bu misolda ftalik kislota deb ataladigan ikki asosli aromatik kislota olinadi.
Maxsus tarzda, kumen, izopropilbenzolning sulfat kislota ishtirokida atmosfera kislorodi bilan oksidlanishini qayd etaman.

Bu fenol ishlab chiqarish uchun kumen usuli deb ataladi. Qoida tariqasida, fenol ishlab chiqarish bilan bog'liq masalalarda bu reaktsiya bilan shug'ullanish kerak. Bu sanoat usuli.
to'qqizinchi mulk - yonish, to'liq oksidlanish kislorod. Benzol va uning gomologlari karbonat angidrid va suvga yonadi.
Benzolning yonish tenglamasini umumiy shaklda yozamiz.
Massaning saqlanish qonuniga ko'ra, o'ng tomonda qancha atom bo'lsa, chap tomonda ham shuncha atom bo'lishi kerak. Chunki, axir, kimyoviy reaksiyalarda atomlar hech qayerga ketmaydi, balki ular orasidagi bog‘lanish tartibi shunchaki o‘zgaradi. Demak, aren molekulasida uglerod atomlari qancha bo'lsa, shuncha ko'p karbonat angidrid molekulalari bo'ladi, chunki molekulada bitta uglerod atomi mavjud. Bu n CO 2 molekulalari. Suv molekulalari vodorod atomlarining yarmiga teng bo'ladi, ya'ni (2n-6) / 2, bu n-3 degan ma'noni anglatadi.
Chapda va o'ngda bir xil miqdordagi kislorod atomlari mavjud. O'ng tomonda karbonat angidriddan 2n bor, chunki har bir molekulada ikkita kislorod atomi mavjud, suvdan n-3, jami 3n-3. Chap tomonda bir xil miqdordagi kislorod atomlari mavjud - 3n-3, ya'ni molekulalarning yarmi ko'p, chunki molekulada ikkita atom mavjud. Ya'ni (3n-3)/2 kislorod molekulasi.
Shunday qilib, biz benzol gomologlarining yonish tenglamasini umumiy shaklda tuzdik.